胰岛素分泌性胰岛细胞瘤
胰岛素瘤在犬不常见,在猫罕见。在人,首例胰岛素瘤的成功外科治疗案例于1935年被Whipple完成。Whipple三联症指的是以下三个现象:神经症状,神经症状与血浆糖浓度低下相关,神经症状可通过口服或注射糖得以缓解。犬的胰岛素瘤在1935年被首次发现。
病理学
胰岛素分泌性beta细胞肿瘤在犬是最为常见的胰岛细胞肿瘤。这可能是因为beta细胞占胰岛细胞的70%。多数犬胰岛素瘤是恶性的。在一项免疫细胞化学报告中,18例胰岛素瘤中,17例是癌,仅1例是腺瘤。约80%的胰腺肿瘤是单生的,且多数位于胰腺两肢之一,而不是生于胰腺体上。有时,眼观检查胰腺未能发现明显的肿瘤,需要进行组织病理学检查。
关于转移灶的发生率,来自不同的研究报告,总计179只犬,从45%至64%,基于尸检的转移率高于基于外科活检的。根据WHO的胰腺肿瘤临床分期系统,TNM系统,I期为T1N0M0(存在原发的肿瘤,不涉及区域淋巴结或不存在长距离的转移),II期为T1N1M0,III期为T1N1M1或T1N0M1。多数胰岛素瘤患犬处于II期或III期。最为常见的转移位置是区域淋巴结和肝脏。根据报道,其他的转移位置还有:十二指肠、肠系膜、网膜、脾、心脏、脊髓。
尽管胰岛素瘤的病因尚不清晰,然而在原发的和转移的犬胰岛素瘤案例中,发现生长激素的生成增加,而该增加与血浆生长激素浓度升高无关。局部的生长激素可通过旁分泌或自分泌的机制影响胰岛素瘤细胞的增生。
病理生理学
Beta胰腺细胞的增生,引起胰岛素的过度分泌,于是出现低糖血症。对于低糖血症最为重要的代偿机制是抑制胰岛素分泌和刺激对抗调节激素的分泌。
糖是调节胰岛素分泌的主要机制。当糖进入Beta胰岛细胞,其被代谢为ATP,随即关闭ATP敏感的钾离子通道,继而降低钾离子的外流,然后Beta细胞去极化,开放电压敏感的钙离子通道。胞浆钙离子浓度增加,引起胞吐胰岛素。在正常的动物,血糖浓度低于65-80mg/dL,胰岛素的分泌会被彻底抑制。而肿瘤化的beta细胞会不顾及血糖浓度持续地分泌胰岛素。所以,胰岛素分泌性肿瘤的特点就是,尽管血糖浓度低下,血液胰岛素浓度还是升高的。
对于低糖血症,有四种对抗性调节激素:胰高血糖素、儿茶酚胺类、生长激素、糖皮质激素。其中,胰高血糖素和儿茶酚胺类是增加血糖浓度最为重要的机制。
病史和临床症状
犬罹患胰岛素瘤的平均年龄为9岁(3-15岁)。尽管任何品种的犬均会出现胰岛素瘤,而报道主要集中在中型至大型的犬种。尚无关于胰岛素瘤品种风险的对照性研究。胰岛素瘤不存在明显的性别倾向。
多数临床症状是源自低糖血症对中枢神经系统的影响,或者源自低糖血症引起的儿茶酚胺类释放。糖是脑的重要能量来源,而神经组织的碳氢化合物的贮备非常有限。所以,脑机能依赖于持续的糖供应。与神经糖缺乏相关的临床症状有:癫痫发作、虚脱、虚弱、共济失调、定向障碍、精神呆滞、视觉障碍。与过度的儿茶酚胺释放和交感神经受到过度刺激相关的症状有:振颤、饥饿、紧张。
伴随着血糖的跌落,临床症状的严重程度增加,严重的低糖血症最终可引起昏迷和死亡。临床症状还可能与低糖血症的持续时间和发展速率相关。因为血糖浓度逐渐地降低,比较不会刺激儿茶酚胺分泌。偶尔地,临床症状是阶段性的,因为对抗性调节激素的分泌,提升了血糖浓度,暂时地消除了神经低糖的临床症状。摄食既能缓解临床症状,亦能恶化临床症状。如果摄食将血糖浓度恢复至正常,临床症状会消失。然而,摄食亦可能刺激胰岛素分泌,并恶化临床症状。禁食、运动、或兴奋能够恶化临床症状:降低血糖浓度、增加交感神经刺激。
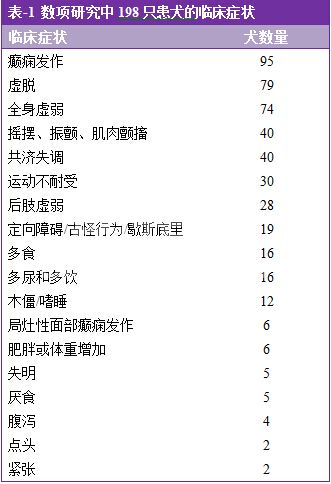
源自各项研究报告,198只犬所发生的临床症状,见表-1。尽管多数犬有一项以上的临床症状,一些犬还没有症状。根据报道,从临床症状出现到获得诊断,时间跨度为1天至3年。
体格检查
体格检查发现在多数胰岛素瘤患犬是不明显的。犬可能由于胰岛素的同化作用是超重的,如果犬最近有过癫痫发作,发作后的症状可能非常明显。在13只胰岛素瘤患犬,出现了以四肢轻瘫和附肢反射降低或缺失为特征的外周多发性神经病。胰岛素瘤相关的外周神经病的病因尚不知晓。据认为,这种多发性神经病的产生和癌旁免疫介导的紊乱相关,而与胰岛素瘤相关的代谢变化无关。
鉴别诊断
低糖血症的鉴别诊断可能有如下几类:①与胰岛素或胰岛素样因子过度分泌相关的疾病;②与糖生成降低相关的疾病;③与糖过度消耗相关的疾病;④药物相关的原因;⑤虚假低糖血症。第一类疾病有:胰岛素瘤、胰腺外肿瘤、胰岛细胞增生。第二类疾病有:肾上腺皮质机能减退、垂体机能减退、生长激素缺乏、肝病、糖原贮存疾病、新生儿、玩具犬。禁食、营养不良、怀孕亦能引起低糖血症。第三类疾病有:败血症、极度运动。在人能够引起低糖血症的药物有:胰岛素、口服降糖药(如磺酰脲)、水杨酸类(如阿司匹林)、醋氨酚、beta阻断剂(如普萘洛尔)、beta2激动剂、乙醇、单胺氧化酶抑制剂、三环抗抑郁剂(如阿米替林)、血管紧张素转化酶抑制剂(如卡托普利)、抗生素(如四环素)、利多卡因过量、和锂。虚假的低糖血症可能出现于如下状况时i:血细胞和血清分离方法不妥、严重的多红细胞血症、白细胞增多血症、分离的血清放置超过1小时。
诊断性检查
对胰岛素瘤建立临床怀疑的基础是:发生了相关的临床症状、血糖浓度低于60mg/dL、同时出现了高胰岛素血症(血清胰岛素水平超过了20微U/mL)。使用影像学检查发现了胰腺肿块能够增强临床怀疑。胰岛素瘤诊断的确立要依靠对胰腺肿块的组织学检查和免疫组化染色。
CBC、生化数据、尿检数据通常除了血糖浓度低下之外,是没有明显发现的。尽管在多数胰岛素瘤患犬,会出现低糖血症(尤其在重复测定血糖时),然而一些患犬在重复测定时,会出现正糖血症。还可能出现的现象有:轻度的低钾血症、血清ALP升高、血清ALT升高。
如果怀疑有胰岛素瘤的犬有着正糖血症,犬应被禁食,然后每1-2小时测定血糖浓度。在多数胰岛素瘤患犬,在禁食的12小时内产生低糖血症。如果确实出现了低糖血症,应采集血样测定胰岛素浓度,然后应给犬喂食。然而,有少数犬在长时间禁食(48-72小时)后重复测定血糖,依然不会出现低糖血症。在一些正糖血症的犬,如果果糖胺浓度低下,可增强胰岛素瘤的临床怀疑。在部分而不是所有的胰岛素瘤患犬,糖基化血红蛋白A1c浓度明显低下。重复测定血清胰岛素水平亦能建立诊断。在一项研究中,在测定一次时,76%的胰岛素瘤患犬血清胰岛素浓度升高;在测定两次时,91%的患犬血清胰岛素浓度升高。
对于有着正常的血清胰岛素浓度的正糖血症患犬,另有测试能够帮助建立诊断。然而,不建议使用胰岛素和血糖之间的比值,因为其敏感性差;也不建议使用修正的胰岛素-血糖比值,因为其特异性差。另有耐受力测试和刺激测试,但并不主张该类测试,因为这类测试的效力存疑,并且会出现致死性的副反应,如低糖血症和癫痫发作。
多数胰岛素瘤患犬有着正常的腹部和胸部X光检查结果。综合数项研究,在87只胰岛素瘤患犬中,腹部超声扫描能够发现49例胰腺肿块(56%),能够发现17例腹部转移灶(20%)。尽管腹部超声有助于增强对胰腺肿块和转移灶的怀疑,但该测试同时存在假阳性和假阴性。
在人,CT是发现胰腺肿瘤最为常用的影像学技术;它能发现50%的直径超过2cm的肿瘤,几乎发现不了更小的肿瘤。仅有少量的胰岛素瘤患犬进行了CT测试,但是其敏感性已被评估。静脉内给以放射性的标记性合成的生长抑素,然后进行全身闪烁计数,该测试在人是一项敏感而特异的胰腺肿瘤影像学测试,该测试已用于一例犬胰岛素瘤。在一项研究中,术中静脉内给以甲基蓝在5只犬的病例中用来为胰腺肿瘤区划特征。
治疗
针对胰岛素瘤的治疗有两方面:针对急性低糖血症危机的治疗、和长期的管理。在急性低糖血症危机期间,可缓慢推注右旋糖(0.5g/kg,IV,使用生理盐水按照1:3进行稀释)。推注右旋糖后,继续静脉内CRI给以右旋糖(2.5%-5%的糖水)。右旋糖必须小心地给以,因为它能刺激胰岛素分泌,引起低糖血症。根据需要进行输液。在多数犬,神经低糖症在给以右旋糖时得以消除。如果动物未能对给以右旋糖出现反应,可给以地塞米松(0.5mg/kg超过6小时IV给以,每12-24小时给以一次))和生长抑素类似物(20-40微克,SC,每8-12小时给以一次)。在严重的病例,在上述治疗的基础上,可在数小时内给以苯巴比妥,直到癫痫发作消除。
据报道,一例胰岛素瘤相关的低糖血症患犬,CRI给以了胰高血糖素(5-13ng/kg/min)。源自低糖血症的临床症状在20分钟内消除,低糖血症在1小时内消除。胰高血糖素通过促进糖原分解和糖异生来增加血糖浓度。然而,胰高血糖素还能增加胰岛素的分泌;所以,应仔细监视动物,以防低糖血症恶化。
关于胰岛素瘤的长期治疗,需要将肿瘤及肉眼可见的转移灶外科切除。对胰腺肿块进行外科探查和活检,还能确认诊断,并能评估存活时间。如果出现了术后高糖血症,其通常是一过性的;一旦正常的beta细胞(之前被肿瘤细胞所分泌的过量胰岛素所抑制的细胞)恢复其机能。然而,还是有10%的犬会出现糖尿病,需要外源性的胰岛素进行治疗1-37个月。其他术后并发症还有:急性胰腺炎、糖尿病酮酸中毒、不愈创、心室性心律不齐、心跳骤停、出血、败血症、白细胞降低血症。
关于药物治疗,我们这里仅讨论自发性胰岛素瘤患犬业已使用过的重要药物。药物治疗的状况有如下三种:外科手术前、外科手术后(如需要)、未执行手术的病例。药物治疗有两方面:细胞毒治疗-直接破坏胰岛素分泌性beta细胞,和用来缓解低糖血症的治疗。
链佐星是一种亚硝基脲抗生素,源自产色链霉菌streptomycesachromogenes。链佐星选择性地破坏胰腺的beta细胞或转移灶的细胞。该药物是肾毒性的,据报道,其能引起犬急性肾衰和肾小管萎缩。使用盐水利尿,能降减少药物与肾小管上皮细胞的接触时间,也许能降低肾毒性的风险。在兽医临床中成功地使用链佐星,目前仅局限于17个犬病例,其多数进行了不完整的肉眼可见病灶的切除。在使用链佐星前,犬接受3小时的生理盐水输液(18mL/kg/h,IV);在使用链佐星期间给以2小时的输液;在给以链佐星之后再给以2小时的输液。链佐星每3周给药一次(500mg/m2)。在给以链佐星后,立即给以布托啡诺(0.4mg/kg IM),作为抗呕吐治疗;但是依然有30%的病例会出现呕吐。其他副作用还有:糖尿病、一过性低糖血症、癫痫发作、一过性高糖血症、一过性ALT活性增加、氮质血症、轻度血小板降低血症、轻度中性粒细胞降低血症。使用链佐星治疗患犬,能够获得正血糖期间,其平均时间为163天。这个时间长度,与接受了外科治疗或药物治疗的对照组相比,没有明显差异。需要进一步的研究,来权衡链佐星治疗的效益和风险。
缓解低糖血症的主要方法有:调整日粮和使用泼尼松治疗、二氮嗪、或合成的生长抑素。推荐少量多食高蛋白的、高脂肪的、复杂的碳水化合物,应避免摄食简单的糖(存在于软、湿的狗粮中)。
泼尼松通过增加糖异生和葡萄糖6磷酸酶的活性、降低组织对血糖的摄取、刺激胰高血糖素的分泌,从而增加血糖浓度。糖皮质激素如地塞米松可在急性低糖血症危机期间静脉内给药,一旦犬稳定,可口服给药。泼尼松是用来治疗犬胰岛素瘤的一种便宜且最为常用的药物,给药剂量为 0.5-4mg/kg/d PO,开始给以下限剂量,按照需要,逐渐增加剂量。
二氮嗪是一种苯并噻二嗪类药物,其主要活性是抑制beta细胞ATP依赖性钾离子通道的关闭、抑制电压依赖性钙离子通道的开放。钙离子内流降低,使得胰岛素的分泌降低。二氮嗪还能在切除了胰腺的犬增加其血糖浓度,通过增加糖原分解和糖异生、及抑制组织对糖摄取的方式。二氮嗪的给药剂量为10-40mg/kg/d PO,每天的药量分成2-3次给以,开始给以下限剂量,按照需要,逐渐增加剂量。使用二氮嗪治疗胰岛素瘤,有效率为70%。犬的副作用并不常见,有:多涎、呕吐、厌食。然而在人,已被报道的副作用有:心肌缺血、盐储留、水储留、高糖血症、低血压、脑缺血。
奥曲肽是一种长效的合成的生长抑素类似物,其主要的作用机制是抑制胰岛素的分泌。在人,奥曲肽的作用取决于其跟肿瘤五种生长抑素受体亚型任何一种亚型的亲和力。犬只有一种生长抑素受体亚型,奥曲肽对犬的效果各有差异。在犬,奥曲肽缺乏可靠的效力,这可能是因为奥曲肽抑制胰高血糖素和生长激素的分泌。如果对胰高血糖素和生长激素的抑制程度与时间长度超过了对胰岛素分泌的抑制,那么,奥曲肽可能实际上会恶化低糖血症。另外,一些胰岛素瘤患犬可能没有生长抑素受体。综上,尚需进一步的研究,来判定奥曲肽在犬的效力和安全性。奥曲肽的剂量为2-4微克/kg SC,每8-12小时给药一次。尚未见到其在犬的副作用报道;在人,其副作用是轻度的,有:注射部位疼痛(可通过使用前将奥曲肽温暖至室温,得以降低该副作用)、恶心、呕吐、腹部疼痛、便秘、脂肪泻。
预后
综合多项研究,对142只经历了胰腺部分切除的患犬调查该病的平均存活时间,为12-14个月(0天-5年)。也调查出了一些预后因子。临床I期疾病的患犬,有着明显更长的无病期间,其50%在术后有望有着14个月的正糖血症期间;而有着临床II期和临床III期疾病的患犬,该比例仅有20%。年轻的犬有着更差的预后。术后有着高糖血症或正糖血症的病例,跟术后低糖血症的病例相比,前者预后更好。
在人,胰岛素瘤的有丝分裂速度降低,是关于存活的重要利好。尽管在犬,也建立了在一个高倍视野下有丝分裂数值和肿瘤局部侵袭性的相关,但尚未建立如下结论:有丝分裂数值高,预后明显更差。
如下因素与预后没有明显相关:年龄、性别、临床症状及其持续时间、超声能够发现胰腺肿块、肿瘤位置、有肉眼可见的转移灶、血糖值、胰岛素浓度值。
猫胰岛素分泌性胰岛细胞瘤
猫胰岛素瘤罕见,见诸于报道的有5只12-17岁的猫。其中3只是暹罗猫,4只是绝育公猫。其病史和临床症状与胰岛素瘤患犬的相似。其诊断基于血清胰岛素浓度在低糖血症期间是增加的。治疗涉及切除胰腺肿块和转移灶,继之以泼尼松治疗和少量多食的饲喂。