肿瘤的病理采样与诊断
对于大部分的肿瘤病例而言,准确的诊断和对肿瘤恰当的分级是对其进行恰当治疗的前提和必须要求。而要达到这样的目的,就有必要利用诸如细针穿刺抽吸,针刺活检,小范围活检和开放式活检这样的检查和操作方法来获得样本,并对获得的样本进行进一步的解读和判读,以求能够获得和肿瘤相关的进一步信息用于之后的治疗和监控。
在上述几种对肿瘤进行的病理采样操作中,细针穿刺抽吸和针刺活检是对动物影响最小的检查方法,对于比较配合的动物,进行这样的操作往往不需麻醉,或是只进行轻度麻醉即可。但是因为这样的方法只能取得少量的细胞或少量的组织,不能对肿瘤的组织进行评估,因此对于某些类型的肿瘤而言并不能得到确诊的结果。不过这种方法可用于在手术前快速的区分炎性病变和肿瘤性病变。使用手术刀或是皮肤用的活检器能够对皮肤或是内脏器官进行微创的活检取样,这样的操作需要对动物进行局部麻醉或是深度镇静,取得的样本具有肿瘤组织的基本结构,因此能够更好的判定肿瘤的类型和对肿瘤进行分级。但是这样的操作采得的组织较小,对于较大的复合性肿瘤或是有周围组织增生发生的肿瘤无法得到对原发肿瘤的确切诊断。开放式活检是诊断大多数实质性肿瘤的诊断金标准,但是这样活检方法对组织的损伤最大,大多数的病例都需要进行全身或局部麻醉。
1. 细针抽吸
细针抽吸通过采集肿瘤中的部分细胞,并对细胞核和细胞质的特征进行判读,从而达到诊断和判定肿瘤类型的目的。这种方法几乎适用于所有类型的皮下和内脏包块,并且能够在采集到深部的组织细胞样本的同时避免被表层的细胞所污染。但是这种方法只能检查肿瘤中极少的一部分细胞,并且无法观察肿瘤组织的结构特征,因此某些情况下并不能达到确诊肿瘤和对肿瘤进行分级的目的。因此很多情况下这种采样检查方法只能作为一种辅助检查手段,而不能作为诊断肿瘤的确诊依据。这种方法可进一步分为通过抽吸进行采样和不通过抽吸进行采样的两类采样方法。
1.1 采样方法
A. 准备恰当的针管和针头: 一般使用内径小于22G(7号针头)的针头和5-20ml的针管进行采样,针头内径如果过细,则采集的细胞容易破裂,针头内径如果过粗,则往往采到的是多层组织,很难制作出单层的可用于解读的细胞学涂片。如果使用抽吸的方法来采集样本,基本的选用原则就是采样的样本质地越柔软,使用的针头和针管的内径越小。
B. 观察判断病畜状态: 如果是情绪稳定的动物,则做好基本保定后可直接采样。如果动物紧张或富有攻击性,或是在鼻垫,指尖等敏感部位采样,则要进行基本的镇静保定或是麻醉。
C. 清洁消毒采样部位: 无论是对皮下包块还是胸腹腔组织进行采样,进针的部位都需要按照手术准备的原则进行准备。如果是用超声引导穿刺,或者采样部位之前做过超声检查,则注意一定要将超声耦合剂擦除,否则超声耦合剂的存在会导致染色异常或是无法染色,导致无法进行判读。
D. 进行采样
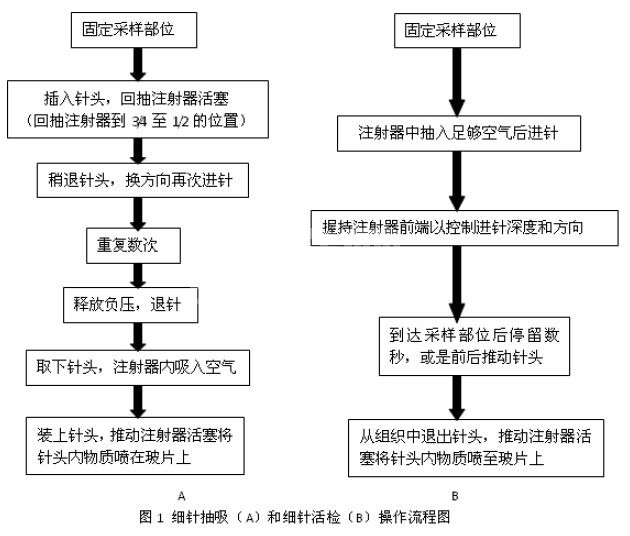
a) 如果是使用细针抽吸的方法,那么就用一只手固定住采样部位组织,另外一只手抓持针管尾部进针。进针后要注意估计针头可能存在的位置。然后回抽针管活塞,将其回拉至针管1/2或2/3的位置后保持其维持在这个位置,利用这样回抽活塞所形成的负压将肿瘤组织中的细胞吸入针头当中。如果是比较大的包块,则可前送或后退针头,转换方向再进行采样。如果担心这样采到的样本为多处组织混合在一起的样本,无法或是很难进行判读,则还可使用不同的针头按照同样的方法进行多处采样。
另外,在回抽活塞形成负压的过程中还可以利用反复松开和回抽活塞的抽吸方法进行采样。这样采样能够提供更为强力的负压吸引力,但是对于细胞脆弱的样本而言,这样的采样方法更容易造成细胞在采样部位的破碎,因此对于疑似淋巴瘤或是疑似肥大细胞瘤这样细胞脆弱的肿瘤病例,要谨慎选用这种反复抽吸的方法进行采样。在采到足够的样本后(一般是看到针头和注射器的连接处有少量样本出现,不过没有出现也可以),回放活塞释放负压后再拔出针头。然后取下针头,针管空吸满空气,将针头中采集样本推压至玻片上(图1,A)。
b)但是如果是采集细胞比较脆弱的组织(如淋巴结),或是采集肿块内的血管比较丰富,或是使用抽吸的方法采出血液或其他类型液体使得不容易进行判读,则可以采用不带有抽吸过程的细针采样方法。这种的方法的使用技术类似于细针抽吸检查,但是需提前在针管中吸入空气,并如同握笔一样手持针管前段进针,预估针头进入采样部位后前后拉动针头,在保证针头在采样区域内的前提下采出样本。采集到足够样本后直接拔出针头,将样本直接推出至载玻片上(图1,B)。也可以使用不带有针管的针头进行采样,但是对于不够配合的犬猫,这样的采样操作不容易保持针头与动物体的位置相对固定,如果动物出现意外的移动容易进针过深或针头脱出。因此总体而言,需要视动物状况,采样部位情况和个人偏好来具体判断使用何种方法。
1.2制作细胞学涂片
制作细胞学涂片的目的是在不破坏细胞的前提下制作出细胞为单层分布的玻片以用于染色后进行细胞学的判读。
A 非液性组织
a.玻片按压推拉法。如果使用得当,这是制作细胞学涂片最好的方法。使用细针活检采集到的样本大部分都可以使用这种方法制作出适于判读的涂片样本。用这种方法制作样本需要将采到的样本滴加到玻片的一端,然后在其上平放上另外一张与之垂直的玻片,依靠玻片自身的重力就可使样本扩散开来。如果是比较大样本或是颗粒型的样本,可能需要稍微需要施加一点压力使其扩散开。
然后水平拉动第二张玻片,使样本随着玻片的拉动而分散开来。使用这种方法一定注意在拉动的时候不能对玻片施加向下的压力,否则细胞很容易就发生破裂而无法解读。
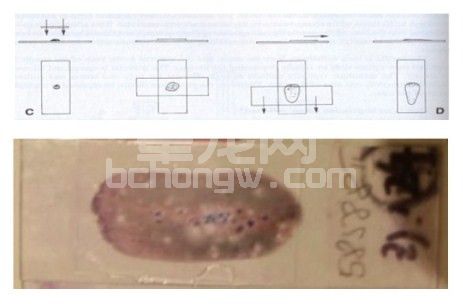
b. 血涂片法。这种方法同使用血液制作血涂片的方法相同,适用于制作细胞脆弱样本的细胞学涂片,例如淋巴结的穿刺液就常常采用这种技术进行制片。
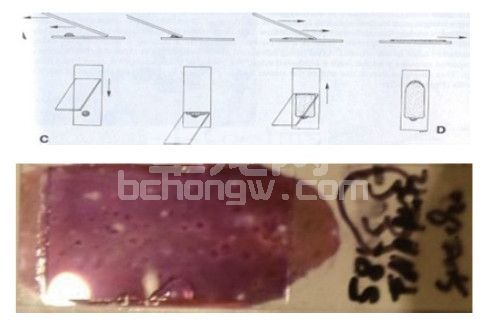
c.针尖涂布法。如果在载玻片上的样本较少,或是使用上述的方法都无法制作出合适的涂片,那么可以利用采样的针尖将样本涂布开来进行制片。这种方法一般不会破坏质地脆弱的细胞,但是如果样本中有较多液性成分,使用这种方法制作出的涂片并不能很好的分离开细胞和液性成分,从而会导致没有合适的单层细胞进行判读。

注意:制作涂片时需要注意检查涂片的厚度。如果涂片过厚,这意味着细胞没有单层分布,这就无法对细胞进行解读。因此用于涂片的材料并不是越多越好。如果采得的样本确实很多,尽量多制作几张涂片以求尽可能的让其中的细胞表现出单层分布。
1.3染色
现在有两种类型的染液可用于细胞学的染色, 一种是Romanowsky染色,在兽医临床中常用的瑞氏染色,吉姆萨染色和Diff-Quik染色都属于这类染色(图2)。这种类型的染色经济实惠,操作简便,耗费时间短,因此在兽医临床上所使用的染色方法几乎全部属于这一类。这种染色方法对有机物和细胞浆的着染非常好,不过对细胞核的染色效果一般,不过已经足以用于判断细胞核的恶性程度。另外一种染色法为Papanicolaou染色(巴氏染色),这种染色为湿染,在人医细胞学中应用广泛,这种方法对对细胞核的着染良好,能够很精细的表现出细胞核内结构,但是其染色操作复杂,染色步骤繁复,因此临床兽医几乎不采用这种染色法。注意:a)一定要使用全新的干净载玻片制作细胞学玻片。
b)使用干净无杂质的染液。如果染液已经使用过一段时间,染色后玻片中可见多量杂志存在,一定要使用滤纸进行过滤,以去除其中的杂质成分。
c)在染色前确保涂片完全干燥。因为很多涂片会大体看起来已经干燥,但是其实还有水分残留。因此在眼观干燥后还需要多等待3-5分钟或是使用吹风机从玻片未染色的一面吹风将其吹干。
d)任何情况下尽量避免接触玻片或涂片表面。
1.4判读
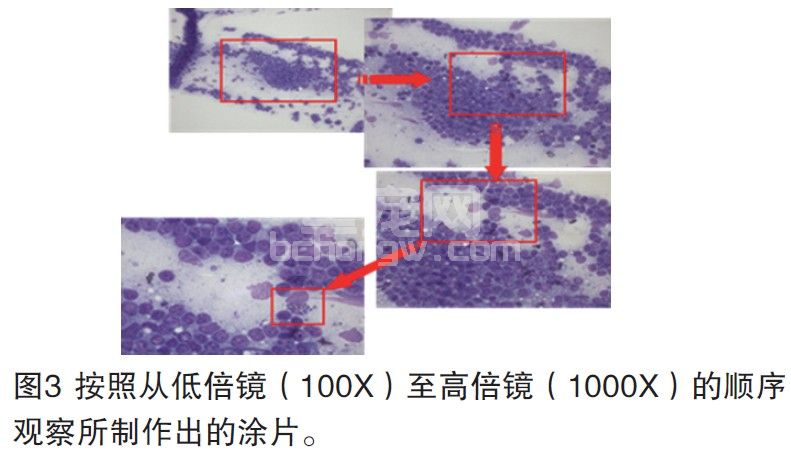
按照从低倍镜至高倍镜的顺序对玻片上的细胞进行判读(图3),注意不要遗漏玻片上的任何一处细胞。
1.5 寄送样本至实验室
如果临床医生无法在诊所或医院内对细胞学玻片做出判读,或是需要确定判读的结果,那么将细胞学玻片寄至专门的实验室或专门的细胞学家处就是细胞学检查的最后一步。
因为玻片的质地脆弱,因此保证玻片经过快递或者邮寄后达到实验室后仍然完整是邮寄样本最基本的要求。不能使用任何软性的外壳包装样本,因为软性外壳非常容易弯折造成玻片碎裂。应该使用专门的硬性塑料玻片邮寄盒或玻片筒(图4),或是使用专用的泡沫质玻片盒。如果是寄送用于细胞学检查的液性样本,那么最好使用EDTA抗凝管盛装样品液体,并在外部用塑料袋密封以防止泄露。
在寄送出的玻片上应该使用记号笔或铅笔标记好采样的部位和动物的相关信息。如果是多张玻片一起寄送,一定要做好标记以表明采样的位置和归属。如果是寄送未染色的玻片,那么不能和任何含有福尔马林液体的样本一起寄送(即使福尔马林是封装在塑料罐中),因为福尔马林蒸汽会导致玻片上的细胞变形,并导致染色性质改变,最后导致无法对涂片进行解读。

2. 针刺活检
因为细胞学只能检查肿瘤组织中的部分细胞的情况,而部分切除活检和手术切除活检要求进行镇定或麻醉,而且对机体的侵袭性相对较大,因此不希望进行侵袭性较大的检查的病例,使用针刺活检采集组织进行组织学检查就能在侵袭尽可能少的情况下得到尽可能准确的诊断结果。同细针穿刺一样,因为针刺活检只是检查肿瘤的一小部分,对于比较大的和比较复杂的肿瘤,这样一小块组织可能得不到正确的诊断,因此用于采样的针管内径越大,采样的部位越多,得到准确诊断的可能性越大。现在已有的一份对照研究报告指出,对于上皮性的肿瘤,使用这种方法采样进行组织病理学检查的结果同手术切除后进行组织病理学检查的结果完全一致,而对于间质性的肿瘤,这种方法采样的结果同手术切除后病理检查结果的一致性为94%。
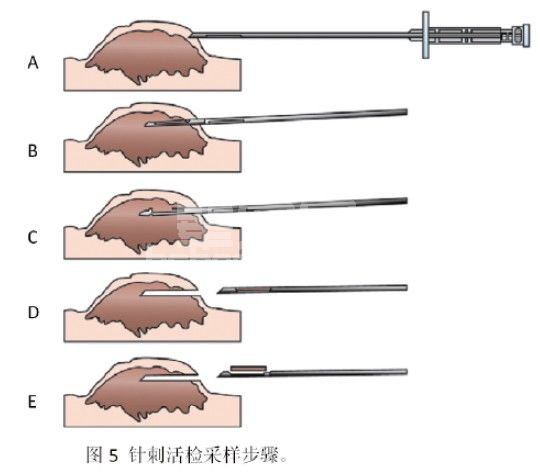
2.1 采样方法(图5)
A.准备恰当的活检针:一般推荐使用14G或16G的套管针进行活检采样,也可以使用商业化的一体化的自动活检针进行采样(自动活检针的采样操作方法视不同品牌的自动活检针不同而不同)。
B.进针:一般仅仅进行镇静或是局部麻醉就足以满足采样的要求,但是如果是对深层的肿瘤进行采样,或是动物不够配合,那么就需要进行全身麻醉才能够达到采样的要求。进针部位按照手术消毒的原则进行的消毒刷洗。如果采样的肿瘤不是位于皮肤表面,或是位于组织深处,那么可以使用手术刀切开表层后再进针采样。保持套管针为闭合状态进针,待针头进入肿瘤中后维持外层套管针不移动,套管内针继续向前,此时肿瘤组织则会由于组织的挤压作用而突出进入套管内针的采样凹槽中。
C.保持套管内针不动,向前移动套管外管针,由于套管外针管壁的切割作用,突出陷进如套管内针采样凹槽中的组织样本就会被切割进入套管针管内。
D.套管针达到闭合状态后整个套管针一起回退,组织样就会保留在针管内一起退出。
E.取出套管针后向前推动套管内针,暴露出位于套管内针凹槽内的样本,就完成一次完整的采样操作。如果有切开皮肤,可使用间断结节缝合闭合皮肤的切口。
2.2 样本的处理
a.可以将采到的样本在干净的载玻片上进行接触按压,制作出细胞学的压片进行迅速的细胞学评估。特别是如果是在手术中进行的采样,进行这样的细胞学压片检查有可能能够迅速的判读肿瘤的类型,为更进一步的决定手术方案提供更多的信息。
b.无论是否进行细胞学的检查,都应该将采到的组织放入10%的福尔马林溶液之中,送检实验室进行组织病理学检查,以求能够最终确定肿瘤的具体类型和对肿瘤进行组织病理学的分级。
3. 小范围活检
这种采样方法同针刺活检相比,可以取得更多的组织,因此在同等条件下,更有可能取得更具代表性的组织用于组织病理学的判断,同时对机体的侵袭性虽然比针刺活检要大,但仍可算作是微创性的采样操作。因此可以根据具体病例情况选用这样的小范围活检方法。针对不同的肿瘤位置和采样要求,有2种不同的小范围活检方法可供选用。
3.1 打孔活检
可以使用皮肤打孔活检器进行活检操作。除了皮肤表面的肿瘤之外,也可以是用这样的方法对内脏器官的肿瘤进行活检操作。但是同针刺活检一样,活检样本越大,活检的部位越多,得到的诊断结果越准确。因此应该根据肿瘤的具体情况配备针对性的活检计划。
3.1.1 采样操作(图6)
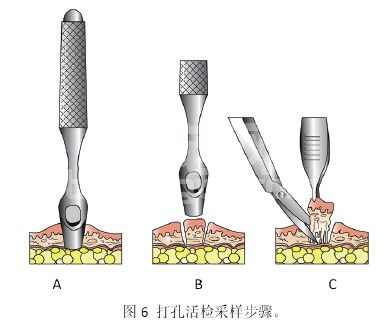
A.可选用直径从1mm至8mm大小的皮肤打孔活检器进行这样的活检操作。对需要进行采样的部位进行局部麻醉(选择活检的部位都要在之后会进行的手术的手术切除范围内),或是给予病畜相应的镇静药物。不过如果是皮肤浅表层已经破溃的肿瘤病变,可能不需要进行麻醉或镇静操作就可直接采样。如果要采样的肿瘤位于皮下或是组织深部,则要先用手术刀切开皮肤或组织后,再固定好肿瘤组织并刺入打孔活检器进行采样。
B. 如果肿瘤团块质地比较致密,可能需要前后反复旋转刺入数次后才能采到符合要求的样本。
C.待打出的孔洞与周围组织分离后,可使用无齿组织镊轻轻夹住并提起组织。如果组织不易脱离出来,可使用剪刀或是手术刀从活检样本的基部切断组织连接处,从而取出活检组织。对于大部分的采样后部位,进行简单的短时间压迫后就基本可以达到止血的效果。皮肤和组织的切口进行简单的间断结节缝合即可。
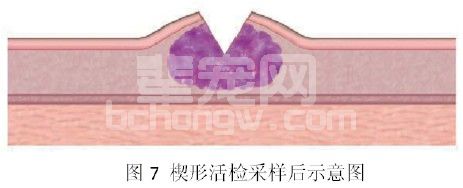
3.2 楔形活检(图7)
按照这种活检方法进行活检能够取得更多的组织用于组织学的判读,尤其是对于纤维化病变比较严重的组织,这样的活检方法能够取得更好的效果,而且这样的楔形切口有利于创口的愈合。其具体采样方法类似于打孔活检,只是不需使用皮肤打孔器,而是使用手术刀在肿瘤组织上切割下一个楔形的活检组织即可。
3.3活检样本的处理
a.通过这两种小范围活检方法采到的样本都可以再干净的载玻片上进行接触按压,制作出细胞学的压片进行迅速的细胞学评估。特别是如果是在手术中进行的采样,进行这样的细胞学压片检查有可能能够迅速的判读肿瘤的类型,为更进一步的决定手术方案提供更多的信息。
b.无论是否进行细胞学的检查,都应该将采到的组织放入10%的福尔马林溶液之中,送检实验室进行组织病理学检查,以求能够最终确定肿瘤的具体类型和对肿瘤进行组织病理学的分级。
4.开放式活检
开放式活检是指通过切除或是切开这两种不同的方式获得活检组织的操作。
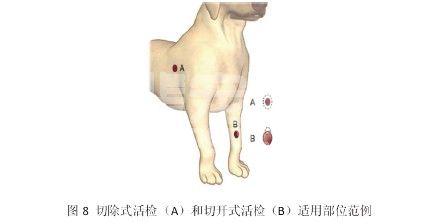
当肿瘤包块较小,周围有足够进行第二次手术切除的正常组织(例如位于皮肤松弛部位的皮肤或皮下肿瘤)时,就可以选用切除式的活检技术将整个肿瘤组织一起切除进行活检(见图8A);当怀疑的肿瘤类型会影响到手术计划或是影响到整个手术计划时(例如当肿瘤的部位皮肤紧张,或是肿瘤位于深部组织中,如果不能一次性切除,则很难进行第二次手术的病例)(见图8B),就应该进行切开式的活检。严格说来,针刺活检,打孔活检和楔形活检都属于切开式活检的范畴。进行切开式活检时,一定要注意切开活检的部位都要位于之后完全切除手术的手术范围之内,否则残留的活检通道可能引起肿瘤的复发和转移。