犬乳腺肿瘤
乳腺肿瘤是母犬最最常见的肿瘤之一。根据不同的统计数据,母犬一生当中发生这种肿瘤的几率从2-20%不等,而发生良性乳腺肿瘤的几率则会高出2-5倍。最近有两个大样本统计的有关发病率的报告发表,一个报告是对英国的病例进行统计,其报道的发病率为每年每10万只犬中有205只会发生乳腺肿瘤;第二个报告则对瑞典有保险的8万只母犬进行了统计,发现每年每1万只犬中有111只会发生乳腺肿瘤。同时这个研究也发现乳腺肿瘤的发生率随着年龄的增加而增大。在6岁时,发病率为1%,而8岁时的发病率为6%,至10岁后,发病率为13%。良性和恶性乳腺肿瘤在犬的某个特定种群中的发病率和犬的预期寿命有关,而且如果犬在年轻的时候进行过子宫卵巢摘除手术,发病率能够大大降低。如果犬曾经使用过孕激素防止发情,则乳腺肿瘤的发生几率会进一步升高。公犬发生乳腺肿瘤的概率为1%,甚至更低。
犬发生肿瘤的平均年龄是10-11岁,小于4岁的犬也会发生乳腺肿瘤,但是非常罕见。依据某些研究的结果,某些猎犬品种,贵宾犬和腊肠犬可能会容易发生这种肿瘤。然而有一份最近发表的研究报告称小型品种犬的乳腺肿瘤发生率同大型品种犬不同。在这个研究报告中,它统计了101个肿瘤病例(60个病例为小型品种犬,40个病例为其他品种),发现小型品种犬的乳腺肿瘤中有25%为组织病理学恶性的肿瘤,而大型品种犬的肿瘤有58%为恶性。犬乳腺肿瘤的发生很显然是激素依赖性的。同未绝育的犬相比,在第一次发情期前就已经绝育的母犬的乳腺肿瘤发生几率为0.05%,而在第一次发情期后绝育的犬的发生几率为8%,而如果犬在第二次发情期后才进行绝育,则发生率升高至26%。在此之后进行绝育并不会减少恶性肿瘤的发生几率,不过可能能够减少良性肿瘤的发生几率。
在一项对137只患有恶性乳腺癌的犬进行的回溯性研究发现,在发生恶性肿瘤后的2年内进行绝育的犬同未绝育或超过2年后才进行绝育,或只是在进行乳腺切除前才做绝育的犬相比,其生存时间更长。在人上已经尽人皆知(早期)妊娠会具有保护作用,但是在犬上并没有显现出这种作用。主要以孕酮为代表的卵巢激素所具有的促发肿瘤作用最有可能是由于他们在与相应的受体结合后所显现出的乳腺细胞的有丝分裂促进活性。正常的乳腺组织同时具有雌激素受体(ERs)和孕酮受体(PRs)(大部分良性肿瘤也具有),通常都会具有较高的水平。而与之相反的是癌变,如果是缺少正常的乳腺上皮,含有的雌激素受体和孕酮受体比较少的病例,则很少会发生转移。
在一项研究通过免疫组化的方法研究了47只犬的85个乳腺病变(28例发育异常,21例良性病变和36例癌变【4例原位癌,32例侵袭性】)中雌激素受体和孕酮受体的表达情况,研究使用正常的乳腺组织作为对比。研究人员发现100%的正常和发育异常组织和95%的良性病变组织测试雌激素受体为阳性。而在侵袭性的癌变病例中,92%的病例显示了一定的雌激素受体着染性,不过只有62%的病例具有强烈的细胞核着染。在正常,发育异常,良性和原位性癌的病变之间没有发现雌激素受体的表达有明显的异常,然而在侵袭性癌变的病例中则发现雌激素受体的表达明显较低。在这同一个研究中也发现同健康组织相比,良性和恶性的病变中的孕酮受体表达水平明显较低。
在另外的一项研究报告中,使用免疫组化的方法对来自100只犬的228个乳腺肿瘤(155个恶性,73个良性)进行了雌激素受体和孕酮受体的表达的评估。在所有的肿瘤中,有76%的样本(96%的良性肿瘤样本,66%的恶性肿瘤样本)表现出了其中一个或两个受体。在7个有淋巴结转移的病例中,原发性肿瘤和淋巴结都不具有孕酮受体和雌激素受体。总的看来,这样的模式提示恶性乳腺肿瘤缺少对类固醇激素的依赖性。催乳素(Prolactin)作为乳腺组织发育的一种重要激素,研究人员也研究了它在良性和恶性乳腺肿瘤病犬病例的组织和血清中的存在情况。同正常的乳腺组织相比,来自于恶性乳腺肿瘤病例的血清和乳腺催乳素(Prolactin)水平明显较高。广为人知的是在雌性犬中,孕酮或诸如氯地孕酮(CMA)或醋酸甲羟孕酮(MPA)这样的合成孕酮能够导致乳腺的完全性小叶腺泡发育,同时由于雌二醇刺激腺管的生长,同时会伴有分泌性成分和肌上皮成分的增生。然而长期给予雌激素并没有显示出会增大犬乳腺肿瘤的发生几率。与之相反的是,给予年轻的雌性比格犬以孕酮主要是导致其发生良性的结节。在实验性的按照高剂量结合给予雌激素和孕酮,或是给予具有孕酮-雌激素活性的药物,能够增大发生恶性肿瘤的几率。现在已经发现用于预防犬发情的注射用孕酮能够增大良性肿瘤的发生几率,但是发生恶性肿瘤的几率不变,不过也还是有报道称其会增大恶性肿瘤的发生几率。给予犬孕酮也显示它能够导致生长激素的分泌增多。这样的孕酮引起的生长激素基因表达现在发现是来源于正常的乳腺上皮。还不知道这样的孕酮刺激分泌的生长激素是否在孕酮刺激发生的犬乳腺肿瘤过程中起到了一种媒介物的作用。
孕酮导致生长激素生成的增多的同时,胰岛素样生长因子I(IGF-I)和胰岛素样生长因子II(IGF-II)的血液中水平也会平行升高,这会刺激乳腺细胞的增生。生长因子和其受体的激素调控和自主表达也可能会影响到乳腺肿瘤的生成,因而使得乳腺肿瘤生成的过程极其复杂。
从在啮齿动物上做的实验研究和对人进行的传染病学研究显示,高脂肪的日粮和肥胖都会增加乳腺肿瘤的发生率。最近在美国对宠物犬进行的一项研究显示,如果宠物犬在9-12月龄的阶段比较瘦,那么发生乳腺肿瘤的几率就会比较低。一个西班牙所进行的调查也发现了相似的结果,在不考虑卵巢切除术的情况下,犬在1岁的时候肥胖是今后发生良性或恶性乳腺肿瘤的危险因素。有些令人惊讶的是,食用自制食物也会增加发生乳腺肿瘤的风险(同喂食商业化日粮相比)。因而营养因素可能也在犬的乳腺肿瘤发生中起到一定的作用。
病理学和自然性质
基于来源于兽医临床诊疗所送检进行组织学诊断的材料,41-53%发生于母犬的乳腺肿瘤是恶性的。恶性的组织病理学证据并不一定意味着恶性的临床病程。同样的,在同一个肿瘤包块中可能能够具有明显不同的组织学表现。
大多数恶性的乳腺肿瘤分类为上皮性肿瘤或癌变。纯粹的肉瘤(纤维肉瘤,骨肉瘤,其他类型的肉瘤)只是一少部分。现在还不清楚发生肿瘤性改变的肉瘤是来源于肌上皮组织还是来自于小叶内结缔组织。没有证据表明肉瘤是起源于既已存在的良性混合型细胞肿瘤。有一部分恶性肿瘤由形态上很像上皮和结缔组织成分的细胞(两者都是恶性的)组成,这样的肿瘤并不常见,被称作癌肉瘤(在某些分类体系中也被称为恶性混合性肿瘤)。良性的乳腺肿瘤包块单纯性/复合性腺瘤,纤维腺瘤,和相对常见的良性混合型肿瘤,这样的混合型肿瘤具有上皮性成分和软骨的间充质成分,和/或骨质成分,和/或脂肪成分,所有的这些成分都可能是来源于多能干细胞。
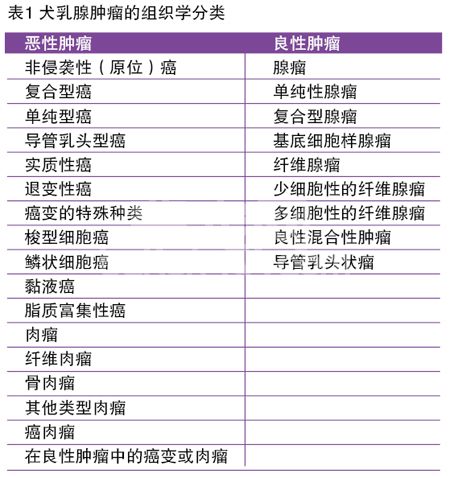
某些组织学的分类系统是在基于对组织的组织学模式的辨识基础上所做成的,这样的分类方法试图去辨识出肿瘤细胞的组织生成的来源。然而这样的分类可能对于判断病变的性质并无参考价值。由世界卫生组织(WHO)所建立的校订后的分类(表1)是试图找出预后权重指标的不同,它将癌变描述和进一步细分为无侵袭性的,复杂性或单纯性癌变(单纯性癌变包括小管乳头型,实质型或退变型)。这种进一步划分被认为是按照恶性的可能性递增的顺序对肿瘤进行分级。
在最近有一个涵盖672只未绝育雌性比格犬的整个生活周期所进行的研究,这项研究对乳腺肿瘤的多灶性特征进行了描述,包括1639个癌变病例在内,这项研究一共统计了4755个肿瘤病例中,有71%的病例至少有一个肿瘤,有61%的病例具有一个以上的肿瘤。基于组织学的分类系统,调查发现癌变,导管型癌变占到19%的比例,而其余的就是来源于其他组织学起源的腺癌。只有73例癌变是致死性的。即使导管型癌和腺癌的总的转移率(局部的加上远端的)差别很小(分别是46%和32%),但导管型癌致死的几率是腺癌的8倍。在这同一个研究中,只在5只犬种诊断出了癌肉瘤,而这五只犬都死于转移性的病变。
另外一个对356只雌性比格犬进行的研究发现,这些犬整个一生中有63%的比例会发生任何类型的乳腺增生或肿瘤,其中有23%的比例会发生恶性肿瘤。在这个研究中,其转移率比较高,在72只患有癌变的犬中达到了77%。同组织学分型相比,癌变对周围组织的侵袭性被认为对预后的影响更大。
一个不同的研究应用从人的病理分级预后体系改进而来的区分系统对158只患有乳腺癌的宠物犬进行了研究。它将癌变按照4种组织学分级进行了分类:
(1)无侵袭性的病变(例如原位癌【级别0】);
(2)侵袭周围间质,但是没有出现明显可见的血管或淋巴侵袭(级别I);
(3)出现血管或淋巴侵袭性和/或转移至周围淋巴结的病变(级别II);
(4)出现远处转移的病理证据的病变(级别III)。根据细胞核的分化(分化不良,中等程度分化或分化良好)还能进一步的对肿瘤进行细分。这样不同的分级和分化程度现在都已发现同肿瘤的侵袭程度具有很明显的联系。
最近由Karayannopoulou和其同事所报道的另外一种分级方式显示出了很明显判断预后的价值。在这个对分级方式的研究中,按照3种不同的标准对每个病例进行评分:小管形成,细胞核多形性和有丝分裂计数。每种标准按照1至3的分数范围进行评分,最后按照所得到的总分将肿瘤分为分化良好(I级),中等分化(II级)或分化不良(III级)。他们对进行乳腺切除术后2年的85例癌变病例进行了很好的回访。作者发现分级为III级的病畜,其存活率明显低于分级为I级和II级的病畜。他们同时发现,同肿瘤分级为I级和II级的病例相比,分级为III级的肿瘤病例死亡率会增高21倍。
除此之外,炎性癌变是一类特殊的肿瘤分类。在一个调查研究中,有186例恶性乳腺肿瘤病例,其中17%的肿瘤被分类为炎性癌变。从组织病理学上来讲,这样的肿瘤是分化不良的癌变,同时伴有单核和多型核的细胞浸润,同时常发生水肿。在组织学上也常见有皮肤的淋巴细胞性受侵袭。从临床表现上,这样的肿瘤生长和转移都非常迅速,并会侵袭皮肤的淋巴系统,导致明显的水肿和炎症。在一个对21个这样的肿瘤进行的研究中,发现所有的这样的肿瘤组织都没有雌激素受体。
病史和症状
乳腺肿瘤在临床上表现为在乳腺中的单个(超过一般的病例)或多个结节,同时发生或是连续发生。如果是受到卵巢激素影响时间较短的母犬,其发生多发性肿瘤的几率比较低。肿瘤可能与乳头相关,但是更常见的是腺体组织自身发生肿瘤。犬具有5对乳腺,所有的这些乳腺都可能发生一个或更多个的良性或恶性肿瘤。大概有65-70%的犬乳腺肿瘤会发生在第4和第5对乳腺上,这可能是因为这两对乳腺所具有的乳腺组织更多。在患有良性乳腺肿瘤的病例中,肿瘤会比较小,包裹良好,并且触摸感觉质地坚实。
恶性的临床征象包括生长迅速,边缘不清,与皮肤或皮下组织粘连,还有溃疡或发生炎症。其中一个或更多个这些征象的出现都可能提示潜在的恶性生长可能性增高。
如同之前所提及的,炎性癌变具有独特的临床表现。如果肿瘤生长迅速,侵袭到多个乳腺腺体和在其上的皮肤,具有坚实、温热、肿胀、发红、增厚和疼痛等征象,就应该怀疑炎性癌变的可能。部分或全部的单侧或双侧乳腺都可能受到病变的波及。四肢或四肢周围组织也可能由于这种类型的乳腺癌而发生严重的淋巴水肿。这样的水肿是由于受到肿瘤波及的淋巴管堵塞,造成四肢淋巴回流的渐进性的减少所造成。虽然炎性的乳房炎在犬上并不常见,但是区分这种类型的恶性肿瘤同炎性的乳房炎区也是很重要的。炎性癌变倾向于非常的坚实,并具有弥散性的肿胀,而乳房炎则更为局限性,并且通常见于发情期,妊娠或假孕之后。炎性的癌变可能也会具有全身性的症状表现。在一个研究中发现,94%发生炎性癌变的犬具有全身性虚弱的症状,会被描述为缺乏能量,活动减少,而与之相比,只有18%的患有其他乳腺肿瘤的犬会具有这样的情况。此外在进行研究的33只发生炎性癌变的犬中都发现了疼痛的症状(100%),而发生其他乳腺肿瘤的犬只有16%表现出疼痛。
转移到腹股沟淋巴结的癌变可能会进入会阴部淋巴系统,并扩散进入髂内淋巴结。可能能够触诊出髂内淋巴结发生的转移,可能会导致对结肠造成的压迫和压力。其他常见的转移部位包括肺脏,肝脏,肾脏和并不常见的骨骼转移。
诊断技术和方法
诊断应该包括一个完全的体检和一项常规的血液学和血清生化指标检查,以求能够评估动物的整体健康状况。对于怀疑有炎性癌变的病例,可能可以进行凝血测试,因为有可能会同时发生弥漫性血管内凝血(DIC)的可能。第一个要进行的评估是要判断局灶性的病变是否可以完全的切除。炎性癌变的出现往往都是和一种血管内的肿瘤(显微镜水平),或是转移性的病变相关,在尝试性的手术后会迅速的发生局部或远端的复发。如果不能排除恶性的可能性,那么就应该在手术前拍摄左侧位,右侧位和腹背侧的胸部X光片,以评估肺部和胸骨淋巴结是否有可能发生转移。在犬上,如果乳腺肿瘤侵袭到尾侧2对乳腺,则应该使用X光检查或B超检查对腰下区域进行检查以评估是否有转移性淋巴结病的可能。直肠检查可能能够触诊出髂内淋巴结病。使用细胞学进行细胞抽吸检查以鉴别良性和恶性的肿瘤现在已经有报道称其为一种敏感性不佳的方法;但是对包块进行细胞学的检查能够排除其他病变的可能,例如炎性病变或是肥大细胞瘤。使用细针抽吸进行细胞学检查可能也会有助于诊断炎性癌变。如果怀疑有淋巴结的转移情况,那么应该使用细胞学来评估怀疑病变的淋巴结。能获得诊断的最确切方法是通过组织活检。临床医生一定注意的是,在术前分辨出良性和恶性的肿瘤并不一定会改变手术的程序。
临床分级
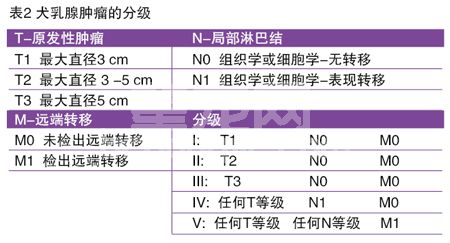
在开始治疗前进行准确,精密的分级是非常重要的一步(表2)。进行评估最重要的是(1)评估原发的肿瘤;(2)评估局部淋巴结;(3)试图找出任何可能的远处转移部位,包括远处的淋巴结和肺部。找出原发性肿瘤的最重要特点是最近快速生长,大小,侵袭性的临床表现(固定于皮肤或筋膜),溃疡和炎性癌变的临床证据。远端转移的最常见部位是肺部;腰下、胸骨和肩前淋巴结;肝脏和很罕见的骨骼部位。
治疗
手术仍然是治疗所有具有乳腺肿瘤的犬治疗选择,不过发生炎性癌变或远端转移的犬除外。手术的方式取决于病变的扩展程度。
手术技术
对是广泛性还是局灶性切除病变在理论和实践层面上的问题,现在已经有大量的讨论已经探讨过这两种手术各自的利与弊。在一项对144只犬进行的前瞻性临床试验中,比较了单纯性的乳腺切除术(例如只移除发生病变的乳腺腺体)同连锁式的乳腺切除手术(例如切除发生肿瘤的一侧乳腺)的结果,结果并没有发现两种不同的手术方式所造成的复发率和生存时间有所差异。支持进行连锁式乳腺切除手术的兽医称这种手术方法能够最大可能的移除所有的肿瘤(已知的和潜在的),同时它能够通过减少有发生肿瘤风险的乳腺组织数量而减少未来发生肿瘤的风险。某些兽医也在基于对某些良性病变的观察之上提倡更为激进的手术,这些被称为非典型的良性病变有可能导致将来发生有侵袭性的癌症的几率增大。这样的一些争议可能对年轻的未绝育母犬上发生的病变而言更有意义。反对进行常规的连锁式乳腺切除手术的兽医称因为超过50%的犬乳腺肿瘤是良性的,因此常规进行这样的手术会导致过度的手术切除;可以在之后对发现有恶性组织学病变的那40-50%的病例再进行更具侵入性的手术切除(尤其是如果切除不完全的病例);并且连锁式的乳腺切除会增高死亡率,手术时间和治疗时间。
手术的主要目的是通过最简单的操作移除所有的肿瘤病灶,同时也要考虑到恶性病变可能会通过淋巴细胞扩展到局部淋巴结。如同之前已经提到过的,通过对局灶性的病变进行更大范围切除以减少发生新的肿瘤的几率的方法可能只是对发生某一亚型的犬有效;但是这并不能防止肿瘤发生潜在的转移。
有很多不同的方法可用于移除犬的乳腺肿瘤,治疗的选择取决于肿瘤的大小,肿瘤是否固定于邻近的组织,病变的数量和可能取得的局部治愈效果的可能性。
局部病灶切除术(结节性切除):这种手术方式适用于小的(小于0.5cm),坚实的,浅表性非固定性结节,而这样的结节通常是良性的。这种方法不适用于已知是恶性的肿瘤。切开皮肤后,从乳腺组织中钝性分离出带有周围一小部分正常组织的肿瘤结节。在切除后,可通过组织病理学评估将肿瘤分类为良性和恶性,然后评估移除的完全性。对于良性的病变,即使移除不完全或是太靠近边缘也可能是可以接受的。如果病变比较小,边缘明显,并且是恶性的,那么切除边缘靠近肿瘤边缘,但是边缘清晰(1-2cm)也是可以的。如果恶性肿瘤移除不完全,那么就需要移除整个乳腺以策万全。
乳腺切除术:对于位于腺体中央部位或是大于1cm的肿瘤,或是出现固定于皮肤或筋膜等情况的肿瘤就需要移除一整个腺体。如果包块侵袭到皮肤和/或腹壁筋膜,那么他们都应该同包块一起移除。基于单个病畜的腺体的融合程度,将第四对和第五对乳腺视为一个整体,和将第一对,第二对和第三对乳腺视为一个整体进行移除比强行的分开离开正常的乳腺组织要更为容易。不过从另外一个角度说,如果单个的腺体是一个单独的解剖结构,那么也可以只是移除单个腺体。
部分乳腺切除术:最开始的时候提议进行局部乳腺切除术是在已知乳腺组织的静脉和淋巴管回流的基础上作出的。在犬上,根据各自位置的不同,其乳腺被分为颅侧胸部乳腺(第一对乳腺),尾侧胸部乳腺(第二对乳腺),颅侧腹部乳腺(第三对乳腺),尾侧腹部乳腺(第四对乳腺)和腹股沟乳腺(第五对乳腺)。根据不同的腺体,从乳腺引流出的淋巴液分别进入腋下淋巴结,腹股沟浅表淋巴结,腰下淋巴结核胸骨前淋巴结。犬乳腺组织的淋巴回流是很复杂的。虽然在所有的腺体之间都可以发生淋巴液的回流,但是最近的一篇报道指出腺体之间主要的淋巴液回流联系主要发生在第一对和第二对乳腺以及第四对和第五对乳腺之间。第一、二、三对乳腺,偶尔还包括第四对乳腺,淋巴液回流至腋下和胸骨前淋巴结。第三,四,五对乳腺,偶尔还包括第二对乳腺,淋巴液主要回流至腹股沟浅表淋巴结。而腹股沟浅表淋巴结则将淋巴液引流至回肠中部淋巴结,然后沿着腰干回流,最终进入乳糜池中。因为有淋巴液回流的问题,因此侵袭第一、二、三对乳腺的肿瘤应该被整体进行摘除。同样的道理,侵袭到第四和第五对乳腺的肿瘤应该连同毗邻的淋巴结一起整体摘除。而腋下淋巴结只有在增大(并可活动),或者细胞学检查发现有转移的恶性细胞的情况下才能够摘除。
单侧性或双侧性的乳腺切除术:如果多个肿瘤或是数个大的肿瘤使得无法通过较简单的操作进行快速大范围的移除,那么可以考虑将第一至第五对乳腺视作一个整体进行移除。对于乳房下垂的犬和猫,即使肿瘤分级,或是单侧乳房切除术更容易进行,也建议同时进行双侧乳房切除术。并不是应为他们能够延长犬的存活时间而选用这种手术,只是因为这种手术比局部病灶切除术或乳腺切除术都要快速。
摘除淋巴结:腋下淋巴结很少受到犬所发生的乳腺癌的波及,因此不应该被预防性的摘除。而且固定的,附着并增大的腋下淋巴结几乎很难被完全的摘除。当腹股沟淋巴结增大,并且细胞学检查提示癌变,或是任何需要移除第五对乳腺的情况时,都需要摘除腹股沟淋巴结,因为该淋巴结与第五对乳腺的关系很紧密。
总的而言,应该使用最简单操作方法摘除在乳腺中已知的犬的乳腺癌癌变。不过这并不是意味着可以不完全的摘除肿瘤。对于年轻的,未绝育并发生多处病变的犬,将来可能出现的风险提示兽医应该考虑对这样病例进行更具侵袭性的手术。
化疗
虽然联合进行化疗是人的乳腺癌病例标准的医护程序,但是现在对于化疗对犬的乳腺肿瘤的有效性还没有足够的信息。基于现在已有的犬乳腺肿瘤细胞种类,多柔比星显示出在体外对克隆出的细胞的抗肿瘤活性;但是这样的活性很少能够在体内也同样有效。在一个有对照试验的小样本研究中(n=16),一半的病例在手术后接受环磷酰胺和5-氟尿嘧啶的治疗,另一半只是进行部分乳腺切除术。所有的犬都是III期的病变,每个组中都有两只犬在组织学上证实具有局部淋巴结的转移。在对化疗治疗组和对照组的结果进行对比后发现,化疗治疗组的无病变期(24个月)和生存期(24个月)明显高于对照组(分别是2个月和6个月)。虽然这个研究的可信度不高,但是这也提示对于某些病例应该结合使用化疗进行治疗。现在还需要进行更多的实验以找出用于治疗犬乳腺肿瘤的理想化疗药物。今后的临床研究的方向应该着重于研究那些具有较差的预后因素的犬(例如肿瘤较大,淋巴结检查结果阳性,有侵袭性,高等级的肿瘤)在进行完全的手术移除后所需结合使用的化疗治疗。
放疗
同化疗一样,现在还没有关于放疗的有效性的相关文献。现在一般认为具有恶性肿瘤的病畜在肿瘤“完全”切除后并不需要进行放疗。
激素治疗
虽然早期进行卵巢子宫切除术能够明确的具有预防犬发生乳腺肿瘤的作用,但是卵巢子宫摘除术对于乳腺肿瘤的治疗作用现在还是未知。在一项对154只犬进行研究中,同时使用乳腺切除术和卵巢子宫摘除术进行治疗,平均生存时间是8.4个月。这个结果同其他只是进行了乳腺切除术的犬平均生存时间为10个月和8个月相比并没有任何优势。最近很多对乳腺癌进行的回顾性研究也没有发现卵巢子宫切除术对于总体的死亡率由任何的改善。有一个研究报告称,在进行乳腺癌切除术的之前2年内或进行手术时进行了卵巢子宫切除术,其生存时间能够长于未绝育或是在进行乳腺癌切除术的2年前进行卵巢子宫切除术的病例。但是这个研究中的分级并不完全,而且在第一组的犬具有更多的预示预后良好的因素(包括肿瘤类型)。因此这个研究并不是一个设计良好的前瞻性研究,它并不能证明卵巢子宫切除术可作为治疗犬恶性乳腺肿瘤的补充治疗方法。
预后
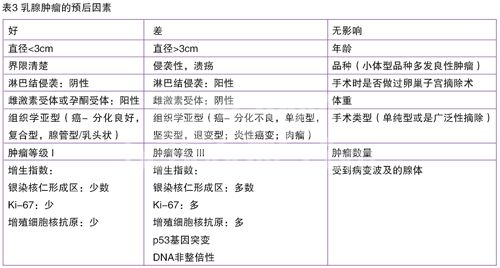
基于所有的单变量和多变量的研究,以下的因素可以被看做是会影响到预后的因素:肿瘤大小,淋巴结受侵袭程度,远端转移的出现与否,组织学类型,恶性分级,细胞核分化的等级,在肿瘤附近的淋巴类细胞的反应性的表现,侵袭的程度,血管内的生长情况,激素受体的活性,作为判定增殖情况的S期片段分数,DNA的非整倍性和银染核仁形成区的数量(表3)。与预后无关的因素有肿瘤位置,肿瘤数量,手术类型(只要达到组织学标准的适当切除即可)和手术时是否进行过卵巢子宫摘除术,不过对于在诊断肿瘤时的年龄的重要性这一点还存有争议。品种以及动物体型和重量的影响也已经进行过评估。一个研究发现小体型的品种生存时间会更长,但是小型品种犬发生良性肿瘤的几率也比较高。在患有恶性肿瘤的犬中,品种和体重并不会影响预期生存时间。
一项对158只患有乳腺癌的犬进行的研究发现在组织学分级(如前段内容所描述的)和乳腺切除术后无病变间期之间的所具有的相关性。患有分级0(原位癌或是无侵袭性)的乳腺癌的犬,在进行初次乳腺切除术后的两年内只有19%的病例出现了复发和转移,而患有分级I的病变(侵袭间质)的犬有60%在手术后两年出现复发和转移,而患有分级II的病变(侵袭入血管或淋巴管)的犬有97%在手术后两年出现复发和转移。对于患有非侵袭性癌变的犬而言,其预后良好。
细胞核的分化程度(例如分化不良,中等或是良好分化的肿瘤)也是影响预后的一个重要因素。具有分化不良性肿瘤的犬在进行乳腺切除术后2年内发生癌变复发或是转移的几率为90%,具有中等分化肿瘤的病例的发病几率则为68%,而分化良好的病例的发病几率则只有24%。一个使用了不同分级标准的研究也发现细胞核的分化程度具有明显的预后提示意义;具有III级肿瘤的病畜生存时间较短,有更大的可能会死于和肿瘤相关的病变。在这个研究中发现肿瘤的大小并不会影响肿瘤的分级,也与生存时间无关,但是淋巴结的转移会使预后更差。
肿瘤周围的淋巴类细胞的活性是与肿瘤的预后相关的另外一个因素。淋巴类细胞的活性可能是抗肿瘤免疫反应的形态学表现。在一个研究中,在进行乳腺切除术时没有表现出淋巴类细胞免疫反应性的病例比表现出该反应的病例会具有明显更高的2年内复发风险。也是在这个研究中,具有组织学分级I级的肿瘤,并表现出淋巴类细胞免疫反应性的犬在2年内出现复发的比例为45%,而没有表现出淋巴类细胞免疫反应性的犬在2年内复发的比例为83%。
乳腺肉瘤被认为预后较差。大多数发生肉瘤的犬在9-12个月内就会死亡。
肿瘤的大小是一个重要的影响预后的因素。世界卫生组织按照最大的恶性肿瘤的直径进行临床分级(见表2)。具有侵袭性的肿瘤,并且肿瘤直径小于3cm的犬同具有直径3cm甚至更大的犬相比,其预后明显更好。在一个对一组具有侵袭到淋巴管或淋巴结转移的犬进行的研究中发现,在T1,T2和T3级别的肿瘤中没有发现生存时间具有明显的差别。而在另外一个研究中,具有T3等级的癌变(直径大于5cm)的犬具有的平均存活时间为40周,而肿瘤要小一些的犬所具有平均生存时间为112周。在一个实验中,具有直径小于3cm的肿瘤的犬的存活时间(22个月)明显长于具有直径大于3cm的肿瘤的犬(14个月)。
在单变量分析中,淋巴结受到病变波及的犬具有更短的无病变生存期,有80%发生淋巴结受侵袭的犬在6个月内出现病变的复发。与之相反的是,具有乳腺癌的犬(肉瘤除外),如果淋巴结未受侵袭,则手术后2年内的复发率为30%或更低。
在诊断出乳腺肿瘤时就已经表现出转移的病例其预后更差。在一个研究中,这样的病例的手术后平均存活时间为5个月,而没有在诊断时发现转移的病例平均存活时间为28个月。