手术部位感染与抗生素的使用
导读:
手术部位感染(surgical site infection,SSI)是人类患者最常见的院内感染之一。在美国,SSI占所有感染病例的16%,占手术病例院内感染的38%。1而根据兽医领域的报道,小动物出现SSI并发症的几率为0.8%-18.1%,发生率因手术类型不同而存在明显差异。2-8SSI的发展可能会引起一系列的问题,包括外观差、医疗费用增加、再次手术、伤口管理时间延长、药物副作用风险增加,甚至造成动物死亡。SSI不能完全避免,但采取一些预防性措施即可以经济而有效地降低其影响。这些措施包括手术期间严格遵守无菌原则、合理使用预防性抗生素(antimicrobial prophylaxis,AMP)、确认高风险动物群体以及术后对手术伤口进行保护。
抗生素的预防性使用
抗生素自1941年被大量生产以来,已被广泛用于医学领域,也包括外科领域。在我国,抗生素在兽医外科领域的使用恐怕是其他国家无法比拟的。就在数年前,兽医在实施犬猫开腹术时还经常在腹腔中放入抗生素,在闭合伤口的过程中也常会在伤口内放置抗生素。这种做法主要是大动物兽医移植过来的,除了是对手术环境的担心以外,盲目依赖抗生素的作用也是原因之一。近几年,随着我们跟国外兽医同行的交流增加,以及获得可靠信息的便利,AMP的应用正在逐渐规范。AMP必须要在潜在性污染期间到达手术部位,以防止病原生长。必须谨记,抗生素并不能代替合理的无菌技术、轻柔和无创的组织操作、仔细的止血、缝线的合理应用、血液供应的保留、死腔的清除和组织的解剖对齐。
表1 伤口污染程度分类
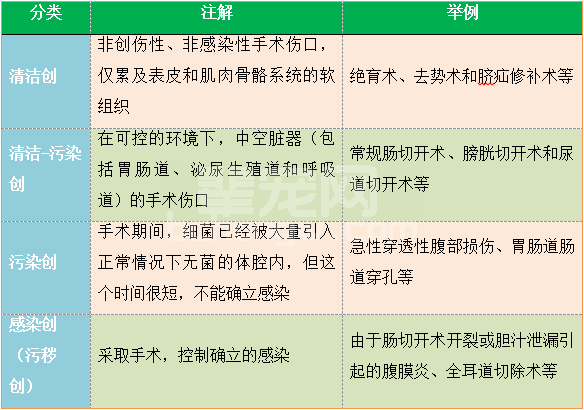
Barie PS, Eachempati SR. Surgical siteinfections. Surg ClinNorth Am 2005;85(6): 1115-35, viii-ix.
特定手术的SSI风险依赖于接种细菌的数量、细菌的毒力和宿主的抵抗力之间的动态关系。10根据伤口污染程度的分类(见表1)有助于预计发生感染的可能性。受污染的程度不同,感染率也有差异。对犬的研究显示,清洁伤口的SSI发生率为0-6%;十字韧带手术清洁伤口的感染率为6%。11,12普遍认为,AMP的使用并不能减小感染的发生率,除非手术由学生来做,或者手术时间超过90min。9Banfield的相关规程也不推荐在去势等小手术中使用AMP。13在我国,虽然没有教学动物医院,但毫无疑问的是,刚入行的兽医最初操作时显然无法很好地执行外科基本原则,手术时间也明显长于有经验的兽医。也有一项研究显示围手术期使用抗生素可以有效地减小选择性骨科手术犬的术后感染率。6而另一项研究则显示,在清洁伤口的动物,围手术期接受AMP和不接受抗生素治疗的SSI发生率无明显差别。14Eugster等的研究显示与接受AMP的动物相比,未接受AMP的动物发生SSI的机会高6-7倍。2因此,AMP也适用于一些清洁手术,尤其是那些骨骼被切开、使用骨科植入物、如果出现感染将是灾难性的或预计手术时间超过90min的手术。
一项对239只犬和猫的清洁-污染手术的研究显示,未去势公犬和同时患内分泌疾病的动物出现术后SSI的比例较高。15据报道,犬污染创的感染率为5.8%-28.6%;长骨和骨盆的污染性骨折和污染的泌尿生殖手术最常发生感染。16这些伤口最初并未感染,但具有出现感染的潜力。早期的管理可以极大程度地改变污染创的命运。精妙地清创、大量灌洗和抗生素治疗能将污染创转化为清洁创,而不充分的治疗则常使其变为污秽的感染创。感染创在手术介入时就已经存在了感染,对这类伤口的管理除了使用抗生素以外,其他的伤口管理措施也非常重要。
使用AMP适用于清洁-污染创,而抗生素的选择则是基于预期的易感菌落。在多数情况下,AMP的使用需要经验性用药。在兽医科学发达的区域,很多兽医诊断中心对引起感染的病原做了大量的统计,这对于我国兽医的用药也具有极大的指导意义。在小动物手术病例,最常引起术后SSI的病原是葡萄球菌属(尤其是凝血酶阳性金色葡萄球菌)、大肠杆菌和巴氏杆菌(尤其在猫)。不同系统手术常见的病原见表2。头孢唑啉对血小板凝集性、出血时间或活化的部分凝血酶原时间均无不良影响;因此在倾向于易发出血性并发症的犬,它是个很好的选择。AMP的使用要遵循的一些基本原则:(1)预防性静脉注射抗生素应该在第一次手术切开前30-60min,(2)根据手术的时长每1.5-2h重复给药一次,(3)在闭合伤口后或至少在24h内停用。9在易发手术切口以外其他部位感染的手术病例也应该考虑使用AMP。研究已经显示,围手术期抗生素的使用可减少椎间盘疾病手术犬泌尿道感染的发生率。
表2 从身体各系统分离出的最常见的细菌
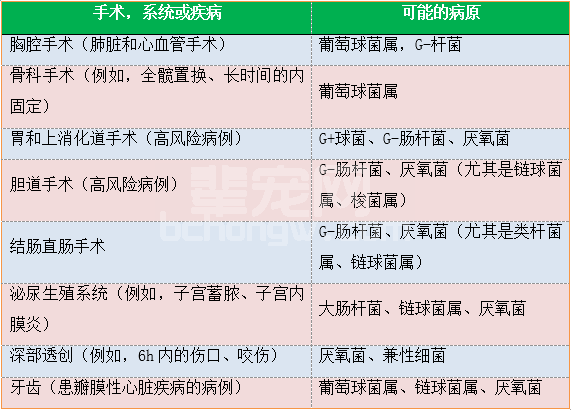
引自Fossum TW, Small Animal Surgery(4th), Elsevier, 2013。
预防SSI的其他策略
术前
在手术前,应该检查动物是否有细菌感染的证据,包括评估皮肤和泌尿道;如果可能的话,延迟手术,直到感染消除。1手术之前应该将一些全身性疾病控制在一定的程度,例如糖尿病或肾上腺皮质机能亢进、过度肥胖、营养不良、贫血、寄生虫感染和低血容量。1如果动物的被毛明显不洁或有体外寄生虫感染,需要在术前洗澡和/或用合理的杀虫剂治疗。应该在将要手术前再剃毛。研究显示,麻醉诱导前剃毛会引起犬的SSI比例升高。
手术成员要进行很好的术前刷洗,指甲要短,要注意清洁指甲下方。前臂的刷洗要到肘部,在穿手术衣和戴手套之前,要保持手离开身体,并高于肘部。1不鼓励使用刷子,因为用海绵进行含水刷洗可取得同样的效果,而且对皮肤的潜在破坏性要小。17现在已经可以获得商品化的含氯己定或聚维酮碘的海绵,供一次性刷手使用。对手部进行准备的目的是为了减小手术人员手部皮肤的细菌,以防手套被刺破后引起感染。据统计,在手术开始后2h,手套被刺破的比例高达35%,其中80%的手套破裂并未被外科医生意识到。17,18手术手套刺破会增加SSI的风险,尤其在未接受AMP的病例。19在数年前,我们还会使用浸泡灭菌的手套,虽然并未有关于这些手套无菌程度的研究,但可以推断其无菌状况要差于一次性使用的预灭菌手套。因此,我们强烈建议使用商品化的一次性预灭菌手套。
术中
合理的手术室设计和管理、以及有效的设备灭菌规程对于限制SSI很重要。1所有在手术室的人员都应该戴帽子和口罩,穿干净的刷手服。有研究显示,在手术室中每额外增加一个人,SSI的风险会升高1.3倍。2这就要求要严格控制手术室的人员数量,禁止无关人员留在手术室。即便是参与手术的人员或者观摩者,也应该尽量减少在手术室的走动。观摩人员也要保持与手术区域的合理距离。由于手术期间手术手套被刺破的普遍性和手套刺破与SSI的相关性,手术人员应该考虑有规律地更换手套,尤其在时间较长的手术18,19。在实施骨科手术时,也可以使用特殊的骨科手套。研究显示戴双层手套会减小关节置换手术SSI的发病率和内层手套被刺破的比例。18一般情况下,重复用的手术衣和创巾要比单次使用的非编织性手术衣和创巾抵抗液体和细菌渗透的屏障作用差。20,21在肢末端的手术,应该采用灭菌的非渗透性屏障防止细菌的渗透。22
手术技术也是影响SSI几率的因素之一。对组织的操作应该轻柔,要有效地止血,清除失活组织,闭合死腔。1,23应该减少手术伤口中的异物、植入物、合成网、缝线和碳化组织,这些都会明显降低伤口对感染的抵抗力。23通过避免使用非可吸收性和多股缝线能减少伤口发生细菌感染的几率。24要根据伤口的污染程度来决定伤口闭合的时间。清洁和清洁-污染创能一期闭合。但对于感染和“污秽”创,则应该进行开放式管理,允许其二次愈合或直到建立健康的伤口床后再进行二期闭合。
对围手术期动物的精心护理也会减少SSI的几率。在人,有研究显示保持正常的核心体温是减小SSI发生率的重要因素,但在兽医病例并未发现体温过低是SSI的危险因素。3,25可通过采用循环水毯和空气加热毯保持正常体温,也可以使用热(40-43度)灌洗液进行胸腔或腹腔灌洗来复温。26在兽医病例,单独的长时间麻醉(无论手术时间长短)也与高SSI风险有关。2,3该发现的意义还不确定,但可能与长时间暴露在麻醉剂之下机体免疫系统反应的损害有关。
术后
一期闭合的手术切口应该用灭菌敷料保护24-48h。1这个阶段之后再对伤口进行覆盖没有益处,并可能使对伤口炎症状况的监测变得困难。7在拆线之前,应该给动物佩戴伊丽莎白脖圈,防止其舔舐伤口。在有些部位,虽然动物舔舐不到,但有可能会抓挠,需要采用对爪部包裹的方式或者用“脚镣”来预防。
小结
合理使用AMP对于减少SSI的发生率有积极意义。抗生素的合理选择要基于对手术伤口类型的了解、对抗生素本身的了解和对特定系统易感菌落的了解。除了经验性用药以外,在感染创或难治的感染,要根据细菌培养和药敏试验的结果来选择抗生素。要减少SSI,单靠抗生素的合理使用是不够的,还需要严格遵守无菌手术原则和合理的伤口管理,包括清创、伤口灌洗、消除死腔、止血和保留血液供应等。
参考文献
1. Mangram AJ,Horan TC, Pearson ML, et al. Guideline for prevention of surgical siteinfection, 1999. Hospital Infection Control Practices Advisory Committee.Infect Control Hosp Epidemiol 1999;20:250-278; quiz 279-280.
2.Eugster S, Schawalder P, Gaschen F, et al. A prospective study ofpostoperative surgical site infections in dogs and cats. Vet Surg2004;33:542-550.
3.Beal MW, Brown DC, Shofer FS. The effects of perioperativehypothermia and the duration of anesthesia on postoperative wound infectionrate in clean wounds: a retrospective study. Vet Surg 2000;29:123-127.
4. Vasseur PB, Paul HA, Enos LR, et al. Infection rates in cleansurgical procedures: a comparison of ampicillin prophylaxis vs a placebo. J AmVet Med Assoc 1985;187:825-827.
5.Vasseur PB, Levy J, Dowd E, et al. Surgical wound infection ratesin dogs and cats. Data from a teaching hospital. Vet Surg 1988;17:60-64.
6. Whittem TL, Johnson AL, Smith CW, et al. Effect of perioperativeprophylactic antimicrobial treatment in dogs undergoing elective orthopedicsurgery. J Am Vet Med Assoc 1999;215:212-216.
7. Weese JS. A review of post-operative infections in veterinaryorthopaedic surgery. Vet Comp Orthop Traumatol 2008;21:99-105.
8. Weese JS, Halling KB. Perioperative administration ofantimicrobials associated with elective surgery for cranial cruciate ligamentrupture in dogs: 83 cases (2003-2005). J Am Vet Med Assoc 2006;229:92-95.
9. Nelson LL. Surgical site infections in small animal surgery. VetClin North Am Small Anim Pract 2011;41:1041-1056, viii.
10. Cheadle WG. Risk factors for surgical site infection. Surg Infect(Larchmt) 2006;7 Suppl 1:S7-11.
11. Frey TN, Hoelzler MG, Scavelli TD, et al. Risk factors for surgicalsite infection-inflammation in dogs undergoing surgery for rupture of thecranial cruciate ligament: 902 cases (2005-2006). J Am Vet Med Assoc 2010;236:88-94.
12. Fitzpatrick N, Solano MA. Predictive variables for complicationsafter TPLO with stifle inspection by arthrotomy in 1000 consecutive dogs. VetSurg 2010;39:460-474.
13. Faunt KK. anesthesia for the pet practitioner. 3rd ed: Banfield PetHospital, 2010.
14. Brown DC, Conzemius MG, Shofer F, et al. Epidemiologic evaluation ofpostoperative wound infections in dogs and cats. J Am Vet Med Assoc1997;210:1302-1306.
15. Nicholson M, Beal M, Shofer F, et al. Epidemiologic evaluation ofpostoperative wound infection in clean-contaminated wounds: A retrospectivestudy of 239 dogs and cats. Vet Surg 2002;31:577-581.
16. Fossum TW. small animal surgery. St. Louis: Elsevier, 2013.
17. Widmer AF, Rotter M, Voss A, et al. Surgical hand preparation:state-of-the-art. J Hosp Infect 2010;74:112-122.
18. Character BJ, McLaughlin RM, Hedlund CS, et al. Postoperativeintegrity of veterinary surgical gloves. J Am Anim Hosp Assoc 2003;39:311-320.
19. Misteli H, Weber WP, Reck S, et al. Surgical glove perforation andthe risk of surgical site infection. Arch Surg 2009;144:553-558; discussion558.
20. Blom A, Estela C, Bowker K, et al. The passage of bacteria throughsurgical drapes. Ann R Coll Surg Engl 2000;82:405-407.
21. Blom AW, Gozzard C, Heal J, et al. Bacterial strike-through ofre-usable surgical drapes: the effect of different wetting agents. J HospInfect 2002;52:52-55.
22. Vince KJ, Lascelles BD, Mathews KG, et al. Evaluation of wrapscovering the distal aspect of pelvic limbs for prevention of bacterialstrike-through in an ex vivo canine model. Vet Surg 2008;37:406-411.
23. Heinzelmann M, Scott M, Lam T. Factors predisposing to bacterialinvasion and infection. Am J Surg 2002;183:179-190.
24. Henry-Stanley MJ, Hess DJ, Barnes AM, et al. Bacterial contaminationof surgical suture resembles a biofilm. Surg Infect (Larchmt) 2010;11:433-439.
25. Barie PS, Eachempati SR. Surgical site infections. Surg Clin NorthAm 2005;85:1115-1135, viii-ix.
26. Armstrong SR, Roberts BK, Aronsohn M. Perioperative hypothermia. JVet Emerg Crit Care 2005;15:32-35.