一例犬先天性脑积水的脑室腹腔分流术治疗
摘要:脑积水是指由于颅腔内脑脊液过度蓄积导致脑室系统扩张的 一种疾病,其中小动物临床中先天性脑积水更为常见。先天性脑积水通常在2-3月龄发病,导致严重神经症状。药物治疗的目的是减少脑脊液的产生和蓄积,将脑脊液分流至另一体腔是脑积水的手术治疗方案。本病例采用脑室腹腔分流术作为手术方案,患犬的临床症状得到明显改善。术后第35天,患犬因颅腔感染死亡。
关键词:犬,脑积水,脑室腹腔分流术
脑积水是指由于颅腔内脑脊液(CSF)过度蓄积导致脑室系统扩张的一种疾病[1]。脑脊液的主要功能是保护大脑和脊髓免受机械性损伤、营养神经组织、维持酸碱平衡、并具有重要的颅内血容量缓冲作用。脑积水可分为先天性和获得性两种。
对于小动物临床而言,先天性脑积水比获得性脑积水更为常见。先天性脑积水通常在2-3月龄发病,出现双眼腹外侧倾斜和颅盖骨突出的典型特征,并导致多种神经症状。前脑症状是为最典型,包括失明、坐立不安、行为改变和共济失调,甚至可能出现癫痫。脑积水的治疗方案取决于病因,大多数病例的治疗只能暂时缓解临床症状[1-3]。药物治疗的目的是减少脑脊液的产生和蓄积,可以使用利尿剂和类固醇。而将脑脊液分流至另一体腔则是脑积水的手术治疗方案,常用的体腔有腹膜腔、心房和胸膜腔,其中腹膜腔的吸收能力最强,应用也最为广泛。
1病史及临床检查
2012年8月1日,动物主人携一只2月龄的雌性马尔济斯杂种犬前来就诊。患犬不能自主摄食,并出现持续性吠叫、转圈、共济失调等临床症状。体格检查可见患犬头部肿大、囟门膨出、双眼向腹外侧倾斜,并有水平眼球震颤和本体反射异常(见图1)。
2影像学检查
以囟门为声窗,对患犬颅腔进行超声检查,可见脑实质萎缩,颅腔内大面积无回声暗区,液面深度约3 cm(图2)。

3实验室检查
3.1血常规检查
血常规检查结果显示患犬出现正细胞正色素性贫血,白细胞检查未见异常。
3.2脑脊液检查
经囟门抽吸患犬的脑脊液进行检查,液体呈红色,性质浑浊、无特殊气味。蛋白含量为300 mg/dL,比重1.020。
4诊断
根据病史、临床症状、体格检查结果、影像学检查以及其他实验室检查结果,初步诊断该病例为犬先天性脑积水。
5手术治疗
患犬头颈部及腹部涉及手术区域均进行大面积剃毛、洗必泰刷洗和碘伏消毒。采用右侧卧保定,头部背腹位保定,并垫高与手术台约呈30°角,以减少对颈静脉的压迫。
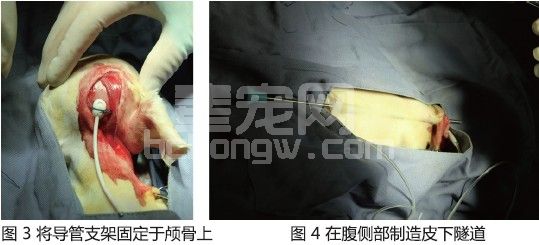
在颈嵴上颞肌筋膜的起点旁,切开其尾侧部分约2~3 mm,将颞肌翻起。使用3 mm球钻,在顶骨尾侧的颈嵴旁钻出一个大小适合,能稳定地安置导管固定支架的孔(即分流孔),在临近此孔尾侧再钻一个较小的孔(即固定缝合孔),将3-0不可吸收缝线穿过两孔并预留在此。检查脑室腹腔分流管,用生理盐水冲洗排空里面的空气。用脊髓穿刺针于大孔内的硬脑膜上做十字切开。
在探针引导下将脑室管呈约30° 角伸入孔内硬脑膜下,抽出探针后即可见脑脊液流出,此时用止血钳暂时夹住脑室管,以免在安置活瓣组件时有过多脑脊液流出。将脑室管穿过导管固定支架,将导管固定支架嵌入分流孔,用预留的3-0不可吸收缝线在导管固定支架表面凹槽内打结,将其牢牢固定于颅骨上(图3)。近端分流管用中国指套结方法将其缝合于颞肌筋膜上。在颅骨的背外侧、耳廓背侧和颈部背外侧,用皮下隧道引导针在皮下筋膜制造皮下隧道。将分流管的活瓣部分置于颈椎区域的中前部。在分离皮下隧道时,要避免导管上出现过度的张力。近端分流管要在皮下组织额外预留长度以适应幼年动物不断增加的体长,小心不要让导管弯折或打结。
在最后肋弓后的侧腹中部区域切开一个小口,将看到的腹外斜肌、腹内斜肌和腹横肌,根据肌纤维走向进行钝性分离。用镊子将腹横筋膜和腹膜提起,切开以打开腹腔后,将腹腔管插入。用3-0单股不可吸收缝线在腹横筋膜进行荷包缝合,并用中国指套结将腹腔外的远端导管进行固定。将各肌肉层用可吸收缝线进行简单连续或间断缝合,将其余腹腔外远端分流管盘环于肌肉层表面。用皮下隧道引导针分离皮下隧道,将腹腔外远端管穿过使其与近端分流管相连接(图4)。
术后拍摄全身右侧位和背腹位X线片,评估分流管放置成功。
6术后药物治疗和结果
患犬术后住院,联合使用抗生素治疗,包括替硝唑15 mg/kg SID IV和头孢曲松50 mg/kg BID IV,并使用痛立定(托芬那酸)4 mg/kg SID SQ进行疼痛管理。术后患犬仍然无法自主进食,需要人工饲喂。吠叫现象消失,转圈频率减少,转圈方向发生改变,眼球震颤现象偶尔出现。8天后患犬拆线后出院。8天内共两次进行血常规检查,患犬的贫血现象得到改善,白细胞计数始终正常。5天后复诊,主诉转圈范围变大,但频率明显减少,没有出现无故吠叫现象。
出院20天后,动物主人携犬复诊,主诉患犬出现头颈上扬现象,人工饲喂时有厌食症状,会将食物吐出,且再次出现低声吠叫现象。检查分流管未见松脱和折转,超声检查见脑积水显著减少,可探及实质性中等偏低回声结构。血常规检查见白细胞总数62.3×109/L,分叶状中性粒细胞53.6×109/L,杆状中性粒细胞1.25×109/L,提示严重感染。患犬再次住院治疗,联合使用抗生素治疗,包括15 mg/kg SID IV和头孢曲松50 mg/kg BID IV,克拉维酸阿莫西林钾 18 mg/kg SID SQ。4天后患犬精神状态显著下降,无法正常站立,持续吠叫,炎症未能得到控制,白细胞总数已达98.5×109/L,分叶状中性粒细胞87.6×109/L,杆状中性粒细胞1.97×109/L。术后第35天凌晨,患犬经抢救无效死亡。
尸体剖检中脑室腹腔分流管未见松脱或折转,引流功能正常,皮下组织未见感染,但颅腔内可见一个体积较大的化脓灶。
7讨论
7.1病史
先天性脑积水通常是阻塞性的(非交流性),怀疑可能与上丘脑融合导致的继发性中脑导水管狭窄有关。出生前或出生后的炎症会使导水管室管膜的表面发生形态改变,并导致继发性狭窄出现。室周憩室和撕裂在自发性脑积水时很常见。继发于小脑蚓部发育不良的脑积水在犬和猫都有报道,这种疾病类似于人医中的Dandy-Walker综合征。MRI检查证实Chiari I型畸形是骑士查理王小猎犬及某些品种的常见问题,但神经症状的严重程度与解剖异常并没有显著关系。
Selby LA 等(1979)研究了564例先天性脑积水病例,提出共11个品种(包括马尔济斯犬、约克夏梗、吉娃娃犬等)的犬患先天性脑积水的风险显著高于其他品种[4]。但Alberta de Stefani等(2011)的研究中涉及的5例先天性脑积水患犬中,3例为大型犬,与以往研究不符。这可能是因为小型犬发病时症状更明显而容易诊断[5]。因此,任何有前脑症状的幼犬都应怀疑先天性脑积水。
先天性脑积水通常在动物2-3月龄时发病,但在Nadia Shihab等(2011)涉及12例犬脑积水手术治疗的研究中,平均发病年龄为10个月[3]。一项涉及564例犬脑积水的调查显示,有30%被最终确诊为先天性脑积水的犬,发病年龄>2岁,这说明很多轻度先天性脑积水患犬在成年前可能不表现出明显的临床症状[4]。
7.2 临床症状
严重的先天性脑积水患犬常出现双眼腹外侧倾斜和颅盖骨凸出的脑积水典型特征,患病动物通常比同窝幼仔的体型小。体格检查可见明显的颅盖骨增大和囟门开放。颅盖骨变形的程度取决于液体积聚程度、脑室增大程度以及颅骨骨缝骨化所处的时期。通常可见眼球斜视,尤其是双眼的腹外侧倾斜最为常见,又称为“落日征”,偶尔也可见背侧倾斜和单侧倾斜[3]。这种症状可能由眼眶畸形导致的机械性压迫或中脑和动眼神经核的解剖异常导致。眼球震颤也很常见,可能是水平、垂直或旋转型都有可能。
脑积水导致的神经症状很多,尤其是先天性脑积水的幼年动物症状更为严重。前脑症状是最典型的,包括坐立不安、行为改变、共济失调,甚至可能出现癫痫。如果视神经或枕叶皮质受损,还可能发生失明。部分动物可见明显的脊柱疼痛,主要以颈椎为主。
7.3治疗
7.3.1手术技巧
将脑脊液分流至另一体腔是脑积水的手术治疗方案。常用的体腔有腹膜腔、心房和胸膜腔三种,其中腹膜腔的吸收能力最强。脑室腹腔分流术的优点在于不受幼年动物体格生长的影响,且容易进行矫正,而缺点则是需要大量分离皮下组织,并且开腹。脑室腹腔分流术已经成功应用于犬,技术上比脑室心房引流术简单得多。
脑室腹腔分流系统供包括三个基础组成部分,脑室管、单通路闸门活瓣和远端腹腔管。通常使用的是不透射线的硅树脂材料。脑室管的末段有很多小孔,有助于脑脊液流通。脑室管与单向活瓣相连接,以便将脑脊液引流至远端腹腔管。活瓣种类通常有低压、中压和高压三种。小动物的脑室腹腔分流术应使用压力活瓣尚未明确。远端腹腔管负责将脑脊液引流至腹膜腔内,腹腔管末端同样多孔,且比脑室管要长[3]。
Joan R. Coates等(2006)提出建议使用低压活瓣[2]。Alberta de Stefani等(2011)的研究沿用了这一观点,使用的是活瓣压力30~45 mm H2O的脑室腹腔分流管[5]。Nadia Shihab等(2011)的研究同样选择低压活瓣,使用的是压力10 mm H2O,流速5 mL/h和压力30 mm H2O,流速50 mL/h活瓣的脑室腹腔分流管[3]。在人医临床中,经常使用活瓣压力可调的分流管,并使用微型传感器实时监测颅内压,以减少过度引流的发生。JM Kim等(2010)采用压力可调节活瓣分流管进行了一例犬的脑室腹腔分流术,该研究中将压力设定为高压(135~155 mm H2O)取得良好效果,并提出高压活瓣有利于减少发生引流过度的几率[6]。Filgueiras Rda.R等(2009)使用的脑室腹腔分流管与本病例中类似,同样都有红宝石球结构,这种人工红宝石的表面非常光滑,可减少蛋白质粘附造成阻塞的几率[7]。
脑室管应插入侧脑室的颞角,插入深度可预先测定,但需要MRI来观察侧脑室颞角的位置[11]。小心不能将气泡留在活瓣内,否则将改变流体压力动力学,建议将活瓣部分缝合于耳后。Woo JN等(2009)采用经囟门放置脑室腹腔分流管的方法,提出此法适用于头骨非常薄或体况差,需要尽可能减少手术时间的动物,这种方法的利弊尚无文献对比讨论。
脑室颈静脉或心房分流术极少使用。需要透视辅助将分流管末端通过颈静脉置入右心房内。Gage ED等(1968)进行了21例犬脑室心房分流术,并有13例获得成功[8]。小动物的颈静脉径可能过小而无法通过远端分流管。
7.4并发症
脑室腹腔分流术的常见并发症包括机械性原因导致的引流失败、感染和过度引流或引流不足导致的功能性引流失败。在人类医学中,术后第一年内的失败率就可达50%。术后前6个月内最常发生的是机械性梗阻和感染[1]。
机械性原因导致的阻塞是最常见的并发症。分流系统的脑室管、远端腹腔管和活瓣部分都很容易受损。CSF引流受阻绝大多数发生在脑室管段。组织块或血凝块常阻塞脑室管,网膜则常阻塞腹腔管。其他常见原因还包括管道扭结、折断和组件脱离。
感染是最严重的并发症。人医术后感染率约4%~10%。大多数感染是术中污染所致,通常发生在术后3~6个月内。其他原因还包括:伤口开裂、导管表面皮肤坏死以及CSF瘘道的形成。分流管导致的皮肤压力性坏死可能导致导管的暴露。导致感染率升高的因素有:术中CSF的泄漏、动物年龄过小或术中过多触碰分流系统。外科医生应尽可能减少与分流管的物理接触,放置时佩戴双层无菌手套。人医研究表明,术中谨慎操作能显著降低感染率[2]。Alberta de Stefani等(2011)的研究中并发症发生率为29%,其中14%出现分流管感染[5]。葡萄球菌感染是最常见的[9],预防性进行抗生素治疗可以有效降低感染率。减少手术室物品和人员、严格无菌操作、预约为早晨第一台手术、减少皮肤暴露以及经验丰富的神经外科医生都能降低感染率的因素[5]。本病例发生的颅腔感染,可能与手术室人员过多,过多触碰分流系统等因素有关。
过度引流会导致颅内压降低并出现硬膜下血肿,这通常是由于脑实质容量减少,颅内压迅速降低引发板障静脉断裂所致。Kitagawa M等(2005)的研究提出,硬膜下血肿可能没有临床症状,但若血肿体积很大或形成迅速,引发颅内压升高会导致一系列临床症状[10]。
7.5分流系统故障的诊断
通过神经学检查来判断症状是改善还是恶化。神经症状(精神状态、呼吸状态、本体反射缺乏等)的迅速恶化通常提示颅内压升高,且分流已经出现障碍。
X线评估通常具有一定效果。全身X线平片有助于判断导管是否断开或扭结。CT或MRI对于评估脑室增大、颅内容物和脑室管组件的位置都很有意义。闪烁扫描法同样有助于确定导管的通畅性,并评价CSF引流。Filgueiras Rda R等(2009)通过向分流管蓄液槽内注射非离子型碘造影剂,并拍摄X线片来判断远端导管是否阻塞[7]。Platt SR等(2012)提出MRI能很好地监控术后脑室增大[11]。
7.6预后
预后取决于病程的严重程度,通常是谨慎的。脑积水严重的病例,神经症状的改善可能微乎其微。主人的期望应该仅限于改善临床症状而非彻底治愈已经存在的神经症状。引流后大脑半球的重建将仅限于白质,且髓磷脂破坏、髓鞘再生和反应性星状细胞增多为特点。Alberta de Stefani等(2011)的研究中先天性脑积水患犬的中值存活时间为274 (60-420) 天[5]。犬的脑室腹腔分流术成功率约50%-90%,这与外科医生的经验有关[2]。
参考文献
[1] Thomas WB. Hydrocephalus in dogs and cats. Vet Clin North Am Small Anim Pract 2010, 40: 143-159
[2] Coates JR, Axlund TW, et al. Hydrocephalus in dogs and cats. Compendium On Continuing Education For The Practising Veterinarian-North American Edition- 2006, 28: 136
[3] Shihab N, Davies E, et al. Treatment of hydrocephalus with ventriculoperitoneal shunting in twelve dogs. Vet Surg 2011, 40: 477-484
[4] Selby LA, Hayes HM, Jr., et al. Epizootiologic features of canine hydrocephalus. Am J Vet Res 1979, 40: 411-413
[5] de Stefani A, de Risio L, et al. Surgical technique, postoperative complications and outcome in 14 dogs treated for hydrocephalus by ventriculoperitoneal shunting. Vet Surg 2011, 40: 183-191
[6] Kim JM, Park J, et al. Treatment of hydrocephalus with high-pressure valve ventriculoperitoneal shunt in a dog. Jpn J Vet Res 2010, 58: 137-142
[7] Filgueiras Rda R, Martins Cde S, et al. Long-term evaluation of a new ventriculoperitoneal shunt valve system in a dog. J Vet Emerg Crit Care (San Antonio) 2009, 19: 623-628
[8] Gage ED, Hoerlein BF. Suegical treatment of canine hydrocephalus by verticuloatrial shunting. J Am Vet Med Assoc 1968, 153: 1418-1431
[9] Bayston R, Brant C, et al. An experimental in-vivo canine model for adult shunt infection. Cerebrospinal Fluid Res 2008, 5: 17
[10] Kitagawa M, Kanayama K, et al. Subdural accumulation of fluid in a dog after the insertion of a ventriculoperitoneal shunt. Vet Rec 2005, 156: 206-208
[11] Platt SR, McConnell JF, et al. Imaging diagnosis--Ventriculo-peritoneal shunt associated infection in a dog. Vet Radiol Ultrasound 2012, 53: 80-83