肠黏膜免疫
摘要:黏膜表面构成了防御外界环境病原微生物的巨大接触面。黏膜免疫系统已经进化成为一个独立起作用的特殊免疫器官。黏膜免疫系统难度较大的作用之一是在保证机体对共生菌和食物抗原不产生免疫反应的同时,对入侵机体的病原微生物引起免疫反应。此系统拥有独特的细胞组成和功能,可以保证其起到双重作用。
关键词:肠道,免疫,黏膜
犬的细小病毒、冠状病毒、犬瘟热病毒和猫的猫瘟病毒等传染性疾病,以及公猫的下泌尿道综合征(炎性)等疾病在小动物临床中属于常见病,这些疾病有传染性也有非传染性,其发病部位也存在很大差异,但有一个共同特征,即都发生于动物机体的黏膜表面,换言之,这些疾病的发生发展与黏膜免疫防御系统息息相关。
黏膜相关淋巴样组织构成了机体内外环境分界最大的免疫器官,主要分布在胃肠道、肺支气管、泌尿生殖系统和外分泌腺体。由于每个部位的黏膜相关淋巴样组织都有各自的特异性,本文重点讨论肠道黏膜免疫系统和肠相关淋巴样组织(the gut-associated lymphoid tissue,GALT)系统。
人类肠道面临着包括共生菌性抗原、食物性抗原和病原体性抗原等形式的潜在抗原负荷。肠道黏膜免疫系统需要将病原性抗原和共生菌性或食物性抗原进行鉴别,保持对病原性抗原的免疫反应,以及对共生菌性和食物性抗原的耐受。黏膜免疫反应的这种特性,不仅可以维持内环境稳态,而且可以作为自身免疫疾病及炎性疾病的治疗方法。
随着对GALT在细胞和分子水平的认识不断加深,发现GALT与全身免疫系统存在很大的差异。GALT有自己独特解剖组成和生理特性[1]。GALT的细胞组成在局限的微环境中,如集合氏节(Peyer’s patches, PPs)和肠系膜淋巴结(mesenteric lymph nodes,MLNs)。GALT的免疫细胞包括T细胞、B细胞和树突细胞(dendritic cells, DCs),同时,系统中还存在独特的细胞,包括微褶细胞(M细胞)、帕纳斯细胞(Paneth cells)和上皮内淋巴细胞(Intraepithelial lymphocyte, IELs)。肠道上皮细胞曾经认为仅仅是一种吸收细胞,但最近发现还是黏膜免疫系统中重要的细胞,同时也是结肠固有免疫中重要的细胞,对炎性结肠疾病的发病机制有很大作用。
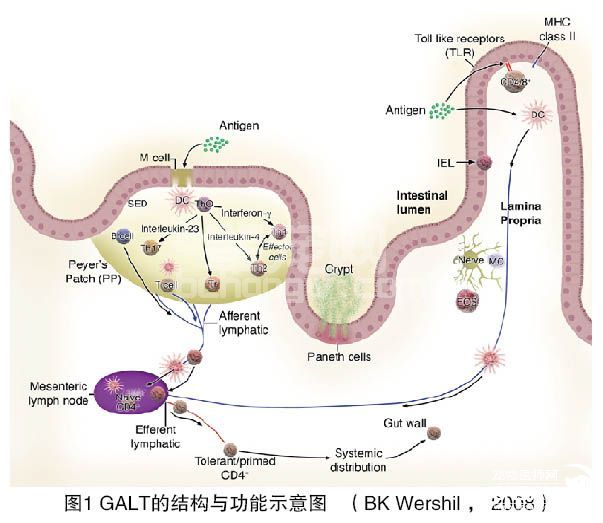
图1简要描述了GALT解剖结构和生理结构,肠腔中的抗原通过M细胞和可能DCs[2],在PPs结中激活未成熟的T淋巴细胞,B淋巴细胞通过淋巴管途径开始向MLNs移行,最后返回结肠中的固有层(Lamina propria, LP)。
1.GALT解剖结构
由图1可见,诱导部位由集合氏结(PPs结)和肠系膜淋巴结(MLNs)组成,而效应部位则由LP组成。
PPs的细胞组成包括大量的B淋巴细胞滤泡,滤泡内有T淋巴细胞区,大量的巨噬细胞和DCs。淋巴样区位于称为滤泡相关上皮(Follicle-associated epithelium,FAE)的单层柱状上皮细胞下。PPs的形成依赖于包括IL-7受体、TNF和TNF受体家族[3]。FAE有大量的M细胞存在,这些M细胞在淋巴毒素αβ的影响下,由肠上皮细胞分化而来[4]。
人类的M细胞与具有吸收功能的肠上皮细胞存在差别,主要是前者缺乏微绒毛和膜相关的溶解酶和简化的多糖蛋白[5]。M细胞在肠道中的存在有部位差异(即结肠和小肠中的M细胞存在差异)。然而,这两个部位中的M细胞功能差异尚不清楚。此外,M细胞单独存在于结肠淋巴样滤泡中的说法受到质疑,因为在集合淋巴结缺失的部位也发现M细胞的存在,称之为肠道绒毛M细胞[6]
M细胞的典型特征是在基底膜外侧中凹入,形成上皮内的“口袋”[7]。大量的CD4+CD45RO记忆T细胞和幼稚型(sIgD+)和记忆型(sIgD-)B细胞和M细胞相互作用。
M细胞的主要功能是将肠腔中的抗原经上皮跨胞转运到上皮下的淋巴样组织。现已证明M细胞可以转运微粒蛋白、细菌、病毒和非感染性颗粒[7]。认为M细胞对肠腔抗原和微生物的“收集”在免疫反应和耐受起到非常重要的作用。然而,在抗原处理和提呈过程中的具体作用仍不清楚。越来越多的研究表明,黏膜免疫反应或耐受并非完全需要PPs[8],并且认为MLNs在全身性反应中属于多余的。
M细胞除了转运病原微生物之外,也能够转运共生菌,认为这是机体对内源性菌群调节免疫反应的机制[7]。
2.黏膜免疫反应的诱导
M细胞和FAE下区域称为上皮下穹窿(Subepithelial dome, SED),在该区域中富含T和B淋巴细胞以及DCs。在PPs中至少有四种不同亚型的CD11c+ DCs,分别是CD11b+CD8α-、CD11β-CD8α+、CD11β-CD8α-和CD11cintCD8α+B220+[9],SED中主要的DCs是CD11c+CD11b-CD8α-,属于“未成熟”亚型[7]。相当多的研究表明PPs中的这些DCs亚群具有亚型特异性[10]。
M细胞基底侧表面有抗原存在的情况下,SED内的DCs能够移行到PPs中,然后进入到滤泡内的T细胞区,实施抗原提呈作用。此外,DCs移行到较远的部位,包括MLNs,甚至到肠道的LP中调节免疫反应。实验性研究证明,DCs的免疫调节作用包括诱导口腔耐受和保护性免疫反应[11]。最近的研究还证明,来自MLNs的CD103+DCs能够将幼稚型T细胞转换成Foxp3+T-调节细胞[12]。
PPs也是IgA+ B细胞发育的主要场所。B细胞发育受到来自从DCs到T细胞,以及局部产生的细胞因子(包括TGF-β和IL-10)细胞信号的影响[12]。IgA+B细胞(和其他免疫细胞)从PPs移出并定居于肠道,其路径是移入MLNs,经过淋巴系统,最后到达肠道的LP。最后一步受到部位特异性黏附分子的调节。调节淋巴细胞移行受到趋化因子CCL25、CXCL12和CCL28的影响[13]。虽然PPs是产生IgA+ B细胞的重要地方,但不完全(约75%)。肠道中产IgA的细胞来自于腹膜B1淋巴细胞(约25%),受到依赖于T细胞方式的共生菌影响,认为这是机体对共生菌所产生的黏膜免疫反应[14]。
B细胞在LP内成熟变成能够分泌IgA的浆细胞。由于α4β7和CCR9的选择性表达而使T淋巴细胞定位于小肠中。在整个LP中可以发现存在CD4+和CD8+T细胞的表达,而在上皮细胞中仅有CD8+T淋巴细胞。LP中的淋巴细胞属于记忆型淋巴细胞,其中CD4+T细胞产生的细胞因子为IFN-γ、IL-4和IL-10。这些细胞很可能代表着效应细胞,即“效应记忆细胞”和调节T细胞,后者辅助B细胞产生IgA,以维持对共生菌或可能其他抗原的耐受性。
3.肠道IgA抗体的产生
IgA抗体分为两种亚型,即IgA1型和IgA2型,其中IgA2型主要存在于黏膜表面。肠道中的IgA主要以多聚体的形式存在,绝大部分为二聚体,通过一个名为J链的多肽结合。二聚体的IgA分泌进入LP。以共价的形式与多聚免疫球蛋白受体结合,后者表达于肠道上皮细胞基地外侧。所形成的复合物以胞转方式穿过上皮细胞进入肠腔中紧贴肠上皮细胞表面。IgA在此以蛋白水解的方式与多聚免疫球蛋白受体解离,在此过程中产生一个称为分泌片段的多肽,但仍然与二聚体IgA结合,在肠腔中防止IgA的降解。
分泌型IgA在肠腔中防止抗原、微生物和其他异物黏附到肠道表面,同时具有中和毒素和感染性有机物的作用[15]。最新的研究发现,IgA也可以调节肠道微环境中的合成物以及限制由病原分子(如LPS)诱导产生的炎症反应[14,16]。
4.肠上皮水平的黏膜免疫
4.1 IELs
IELs是黏膜淋巴细胞一个重要的亚群,主要位于基底膜以上,肠上皮细胞连接处。IELs移行到该处受到CCD9/CCL25(表达于胸腺的趋化因子)和αEβ7 (CD103)/E-钙粘着蛋白的影响。
IELs属于淋巴细胞的异质性细胞群,主要由γδT细胞受体(TCR)CD8+T细胞和两种不同的αβTCR细胞亚群,αβTCRCD4+或αβTCRCD8+,以及那些没有表达共同受体,称之为双阴性细胞。所有IELs亚群的共同特征是能够表达CD8αα,后者是将活化的T细胞诱导到肠道中[17]。
肠道IELs表达的TCRs具有种属和部位特异性。人类小肠中约70%的IELs属于CD8+细胞,αβTCR CD8+IELs是结肠中的主要IEL细胞,γδTCR CD8+约占到10%[17]。与其他T细胞群不一样,IELs的发育不依赖于MHC I类或II类所提呈的抗原,且IELs具有的TCR受体数量有限。
IELs的功能也许很多,但目前对此的了解甚少。有研究表明IELs在维持肠道内稳态中起到重要作用[18]。IELs也参与到某些病原体的保护性反应中,甚至对肿瘤起到监视作用[17]。
4.2 潘纳斯细胞
潘纳斯细胞是肠道中一种独特的上皮细胞类型,位于小肠隐窝基底,主要参与到固有免疫反应。潘纳斯细胞含有各种抗微生物肽,主要是α-防御素,同时也含有溶酶体和分泌性磷酸酶A2。研究发现,α-防御素具有抗革兰氏阳性和革兰氏阴性菌,以及可能抗病毒作用[19]。
4.3 肠上皮细胞
之前对肠上皮细胞的认识认为其主要作用是吸收营养,其在黏膜免疫中的作用是屏障功能和转运分泌性IgA。但是最近的研究发现,肠上皮细胞在黏膜免疫中的作用远不止这些,可以作为一种非专业的抗原提呈细胞,能够识别细菌和病毒,并以表达核肽-结合低聚反应域和Toll样受体对其作出反应,同时产生各种细胞因子和趋化因子来影响免疫反应[20]。此外,肠上皮细胞可以影响T-调节细胞在肠道中的表达[21]。
肠上皮细胞在固有免疫和获得性免疫中的具体作用有待进一步的研究,但可以肯定的是肠上皮细胞通过各种机制和分泌产物,调节淋巴细胞活性和控制局部的炎症反应,进而维持机体的内稳态。
5. 总结
黏膜免疫有其自身独特的解剖结构和生理学特征,这些特征共同维持机体对食物性抗原和共生菌的耐受性,并对病原性微生物产生反应。LP中的淋巴细胞、DCs、肥大细胞和嗜酸性粒细胞共同构成一个多功能网络,对可能潜在的病原体作出固有免疫和获得性免疫反应。黏膜免疫系统的正常反应调控机制对更好地控制肠道疾病有很大的帮助,同时也有助于控制其他与黏膜相关的疾病。
参考文献
[1] A.M. Mowat, Anatomical basis of tolerance and immunity to intestinal antigens, Nat Rev Immunol. 3 (2003) 331-341.
[2] M. Rescigno, M. Urbano, B. Valzasina, M. Francolini, G. Rotta, R. Bonasio, F. Granucci, J.-P. Kraehenbuhl, P. Ricciardi-Castagnoli, Dendritic cells express tight junction proteins and penetrate gut epithelial monolayers to sample bacteria, Nat. Immunol. .2 (2001) 361-367.
[3] Y.-X. Fu, Development and maturation of secondary lymphoid tissues, Annual Review of Immunology .17 (1999) 399-433.
[4] N.S. Debard, BrowningA., Jeffrey Kraehenbuhl, JeanAìPierre, Effect of mature lymphocytes and lymphotoxin on the development of the follicle-associated epithelium and M cells in mouse Peyer's patches, Gastroenterology. 120 (2001) 1173-1182.
[5] J.Z. Harvey Miller, Rhonda KuoLee, Girishchandra B. Patel, and Wangxue Chen, Intestinal M cells: The fallible sentinels?, World J. Gastroenterol. .13 (2007) 1477-1486.
[6] M.H. Jang, M.-N. Kweon, K. Iwatani, M. Yamamoto, K. Terahara, C. Sasakawa, T. Suzuki, T. Nochi, Y. Yokota, P.D. Rennert, T. Hiroi, H. Tamagawa, H. Iijima, J. Kunisawa, Y. Yuki, H. Kiyono, Intestinal villous M cells: An antigen entry site in the mucosal epithelium, Proceedings of the National Academy of Sciences of the United States of America. 101 (2004) 6110-6115.
[7] M.R. Neutra, N.J. Mantis, J.-P. Kraehenbuhl, Collaboration of epithelial cells with organized mucosal lymphoid tissues, Nat. Immunol.. 2 (2001) 1004-1009.
[8] D. Kunkel, D. Kirchhoff, S.-I. Nishikawa, A. Radbruch, A. Scheffold, Visualization of peptide presentation following oral application of antigen in normal and Peyer's patches-deficient mice, European Journal of Immunology. 33 (2003) 1292-1301.
[9] J. Bilsborough, J.L. Viney, Gastrointestinal dendritic cells play a role in immunity, tolerance, and disease, Gastroenterology. 127 (2004) 300-309.
[10] J.H.R. Niess, Hans-Christian, Dendritic cells: the commanders-in-chief of mucosal immune defenses, Current Opinion in Gastroenterology. 22 (2006) 354-360.
[11] J.L. Coombes, K.R.R. Siddiqui, C.V. Arancibia-Crcamo, J. Hall, C.-M. Sun, Y. Belkaid, F. Powrie, A functionally specialized population of mucosal CD103+ DCs induces Foxp3+ regulatory T cells via a TGF-β and retinoic acid-dependent mechanism, The Journal of experimental medicine. 204 (2007) 1757-1764.
[12] S. Fagarasan, T. Honjo, Intestinal IgA synthesis: regulation of front-line body defences, Nat Rev. Immunol.. 3 (2003) 63-72.
[13] E.P. Bowman, N.A. Kuklin, K.R. Youngman, N.H. Lazarus, E.J. Kunkel, J. Pan, H.B. Greenberg, E.C. Butcher, The Intestinal Chemokine Thymus-expressed Chemokine (CCL25) Attracts IgA Antibody-secreting Cells, The Journal of experimental medicine. 195 (2002) 269-275.
[14] A.J. Macpherson, D. Gatto, E. Sainsbury, G.R. Harriman, H. Hengartner, R.M. Zinkernagel, A Primitive T Cell-Independent Mechanism of Intestinal Mucosal IgA Responses to Commensal Bacteria, Science .288 (2000) 2222-2226.
[15] J.R. Mestecky, M. W. Elson, C. O., Intestinal IgA: novel views on its function in the defence of the largest mucosal surface, Gut.. 44 (1999) 2-5.
[16] P.M. Reilly, K. Bass, K. C. Fuh, U.Haglund, G. B. Bulkley, The mesenteric hemodynamic response to circulatory shock : An overview, BioMedical Press, 2001.
[17] H. Cheroutre, Starting at the Beginning: New Perspectives on the Biology of Mucosal T Cells, Annual Review of Immunology. 22 (2003) 217-246.
[18] H.W. Koon, C. Pothoulakis, Immunomodulatory Properties of Substance P, Annals of the New York Academy of Sciences. 1088 (2006) 23-40.
[19] B. Ericksen, Z. Wu, W. Lu, R.I. Lehrer, Antibacterial Activity and Specificity of the Six Human {alpha}-Defensins, Antimicrob. Agents Chemother. 49 (2005) 269-275.
[20] S. Dahan, F. Roth-Walter, P. Arnaboldi, S. Agarwal, L. Mayer, Epithelia: lymphocyte interactions in the gut, Immunological Reviews. 215 (2007) 243-253.
[21] J.B. Matthieu Allez, Iris Dotan, Lloyd Mayer, Expansion of CD8+ T cells with regulatory function after interaction with intestinal epithelial cells, Gastroenterology. 123 (2002) 1516-1526.