犬干扰素对犬细小病毒病的药效试验
摘要
目的:本试验通过犬细小病毒疾病模型的复制,考察注射用重组犬干扰素α突变体(冻干型)对人工复制毕格犬细小病毒病的疗效。
方法:将所有发病毕格犬随机分为8组(5只/组):(1)感染对照组;(2)辅助治疗组;(3)单独干扰素治疗组(40万单位/kg);(4)低剂量干扰素治疗组(20万单位/kg);(5)中剂量干扰素治疗组(40万单位/kg);(6)高剂量干扰素治疗组(80万单位/kg);(7)第二批次中剂量干扰素治疗组(40万单位/kg);(8)第三批次中剂量干扰素治疗组(40万单位/kg)。
结果:第1组2只死亡;第2组1只死亡;第3组2只犬于给药治疗后第3天和第4天死亡;第4组5只犬中仅有1只犬于给药后第2天死亡;第5组与第6组的犬均于连续给药3-4天后出现明显好转;第7组和第8组的犬均于连续给药3-4天后出现好转。
结论:北京铁草科技有限公司生产的注射用重组犬干扰素α突变体(冻干型)皮下注射给药7天,同时结合对症治疗措施,可有效控制人工感染的毕格犬细小病毒病,改善临床症状,缩短疗程,显著降低死亡率;给药剂量以40-80万单位/kg的治疗效果最佳;疗效稳定,批次间无显著差异。
关键词:干扰素α;细小病毒;犬
1.引言
重组犬干扰素α突变体是具有高活性的新一代犬干扰素α产品。具有广谱抗病毒作用:抑制细胞内病毒复制和增殖,无论天然病毒,还是变异病毒都可有效抑制。且具有提高免疫力的作用,促进机体巨噬细胞、淋巴细胞和NK细胞的功能,可清除细胞外的病毒。可用于治疗犬病毒性疾病,如犬瘟热、犬细小病毒感染、犬腺病毒、犬副流感、犬冠状病毒感染、犬疱疹病毒感染、犬病毒性角膜炎等。
犬细小病毒病是20世纪70年代末发现的由CPV引起的一种急性接触性传染病。临床上以剧烈呕吐、出血性腹泻及高度沉郁为特征,主要危害幼犬(1岁内),发病率和死亡率都很高,但如果及时正确诊断,及时合理治疗,同时加强护理可以大大降低死亡率。目前常用的方法是在疾病早期应用干扰素或高免血清、单克隆抗体的同时,进行强心、补液、抗菌、消炎、抗休克等对症治疗。
2.材料与方法
2.1 试验材料
注射用重组犬干扰素α突变体(冻干型),共三批次,20080101,20080301,20080401,由北京铁草科技有限公司提供。4℃保存备用。临床用前以灭菌生理盐水稀释后应用,现配现用。
其他试剂:各种培养基,细菌学检查用各种试剂,抗血清等。
犬细小病毒快速诊断试纸,北京世纪元享动物防疫技术有限公司。
胎猫肾传代细胞(FK81),由扬州大学畜禽传染病实验室保存。
实验器材:微生物分离、培养、鉴定用器材,显微镜等。
2.2 犬细小病毒种毒
毒株代号为CPV-2-2。来源:分离自扬州大学动物医院疑似感染犬细小病毒死亡犬的粪便,由扬州大学兽医学院预防兽医学教研室鉴定并保存。
2.2.1 毒力测定
按常规方法用猫肾细胞系(FK81)细胞测定犬细小病毒的组织细胞半数感染剂量(TCID50)。96孔板用含2 μg/ml胰蛋白酶的RPMI1640液洗细胞一遍后,逐孔加入10倍系列稀释的病毒液(10-1-10-7),50 μl/孔,每稀释度平行4孔,另设正常细胞对照,置37℃、5%CO2中吸附2h后弃去病毒液,换入RPMI1640液,继续孵育72h,观察CPE,根据Reed-Muench方法对病毒滴度进行计算。
2.2.2 病毒滴度测定
测定血凝价(HA)
① 猪醛化红细胞的制备
加枸椽酸钠作抗凝剂的无菌新鲜猪血,用5倍于红细胞压积的PBS(pH=7.2)充分洗涤5次,每次1500rpm 5-10min,直至上清测定无蛋白质(用饱和硫酸铵滴定上清,观察有无白色沉淀),再以相同缓冲液配制成25%红细胞悬液;25%红细胞与20%甲醛以2.5:1的比例混匀,37℃水浴作用2h;每15 min振荡一次,红细胞颜色由鲜红色转变为棕色;取出,以pH7.2 PBS洗涤4次,每次2000rpm 10 min,再加同样的PBS,制成25%红细胞;重复第三步醛化一次,同法洗涤;最后配制相当于20%醛化红细胞悬液,并加入0.01%硫柳汞防腐,分装,4℃保存备用。
② 血凝价(HA)的测定
将含有病毒感染的细胞悬液反复冻融3次后,在96孔V形板上用PBS按1∶2、1∶4、1∶8…等倍比稀释病毒原液,用1%的猪醛化红细胞作血凝试验,每孔加红细胞50 μL,以50%的红细胞凝集为终点,于4℃静止1h后判定结果:样品出现凝集终点的最高稀释度为HA滴度,同时设立红细胞对照。
2.2.3 种毒鉴定方法及结果
采用PCR法进行犬细小病毒种毒鉴定。
① PCR引物合成
本试验所用的引物参照文献合成,运用套式PCR:第一轮PCR反应用引物P1+P2;第二轮PCR反应用引物P1+P3。第一轮PCR扩增产物大小为1247bp;第二轮PCR扩增产物大小为746bp,引物的序列为:
P1:5'-TCCAgCAgCTATgAgATC-3'(3342-3360nt)
P2:5'-gATCTgTTggTAgCAATAC-3'(4570-4588nt)
P3:5'-gATCTgTTggTAgCAATAC-3'(4070-4088nt)
上述引物由上海生工生物工程技术服务有限公司合成。
② PCR模板DNA的制备
取疑有CPV感染的细胞悬液(产生CPE,对猪醛化红细胞有HA作用),反复冻融3次以充分裂解细胞。取500μL冻融后的细胞液,加入蛋白酶K至终浓度为500μg/mL,加入SDS至终浓为1%,充分混匀后,置55℃水浴作用30min。然后分别用Tris饱和酚(pH 8.0)、苯酚:氯仿(1∶1)各抽提一次,吸取水相,加1/10体积3mol/L NaAc(pH5.2)及2.5倍体积无水乙醇沉淀,置-20℃10min。12000rpm离心15min,沉淀用70%乙醇洗涤,晾干后悬浮于30μL含RNase A(20μg/mL)、无DNase的TE(pH 8.0)(RTE)中。
③ PCR反应
PCR反应体系(50μL)为:
10×Reaction buffer(with 15mmol/L MgCl2) 5 μL
dNTPs(2.5mmol/L) 4 μL
引物P1(25μmol/L) 1 μL
引物P2(25μmol/L) 1 μL
DNA模板 2 μL
TaqDNA聚合酶 1 μL
超纯水 36 μL
PCR反应参数:94℃,5min,然后94℃,30s,50℃,2min,72℃,2min,30个循环,最后72℃,10min。
④ 琼脂糖凝胶电泳
取PCR产物5 μL,加超纯水15 μL、6×loading buffer 4 μL混匀,3%琼脂糖凝胶(含溴化乙锭0.5 μg/mL)电泳,电泳缓冲液为0.5×TBE(5.5g Tri·HCL,2.75g的硼酸,2mL 0.5M EDTA,加蒸馏水至1L),恒压80伏45min。
2.3 实验动物
55-70日龄未接种过犬细小病毒疫苗的毕格犬共40只,雌雄兼有,由扬州四方实验动物科技有限公司提供。接种病毒前观察7天。为避免肠道寄生虫对实验结果的影响,观察期间应用阿苯达唑进行驱虫(25mg/kg内服,每日一次,连续三次)。
饲养方式:引进动物前对饲养房间、用具全部以2%氢氧化钠溶液进行喷雾和浸泡消毒。每天饲喂2次,饲料为商品化狗粮,自由饮水。
符合试验条件的犬应临床表现健康,体温、白细胞总数等检查结果均正常。粪便以犬细小病毒快速诊断试纸进行检查,结果均为阴性。
2.4 疾病模型复制
除健康对照组以外,所有试验犬经隔夜禁食后,均每1kg体重肌肉注射0.2×10-7/100 μl TCID50的病毒(接种剂量经两次预试验确定)。
① 临床症状观察及剖检 接种后,每日两次观察临床症状(如精神状态、呕吐、腹泻、便血等),对表现异常的犬测肛温。对发病死亡犬进行剖检,重点观察小肠及肠系膜淋巴结的组织变化。
② 细小病毒快速诊断 根据发病情况和典型的临床症状初步诊断为犬细小病毒感染的犬,再用犬细小病毒快速诊断试剂盒进行确诊。以无菌棉拭子取病犬直肠粪便,加生理盐水约2mL,充分振动静置3min,吸取上清液加入试剂盒中,约5min后观察结果,呈现一条红线为阴性,两条红线为阳性。
③ 犬细小病毒的分离培养 取病死犬十二指肠或空肠内容物,加生理盐水及双抗,混匀静置后,上清液用滤器过滤(滤膜孔径为0.22 μm)除菌。将长成单层的FK81细胞用胰酶消化后按1∶2分瓶,取过滤好的上清按照约细胞培养上清量的1/3接种FK81细胞,同时设立阴性对照,37℃静置培养,24h后将细胞生长液(含10%小牛血清、30 μg/ml L-谷氨酰胺的DMEM)换成维持液(不含小牛血清、补加90 μg/ml L-谷氨酰胺的DMEM),逐日观察CPE,若经盲传3代后,产生CPE,则继续传代。
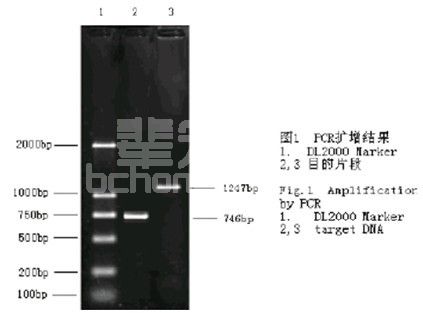
④ PCR检测 提取分离到的病毒基因组DNA,并以此DNA为模板,采取人工合成的正反引物进行PCR扩增,PCR产物经琼脂糖凝胶电泳鉴定是否获得了预计长度的DNA片段(1247bp和746bp)。
2.5 实验动物分组及治疗
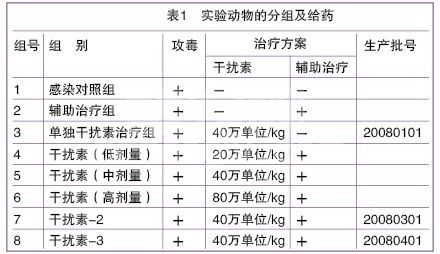
所有实验犬随机分为8组,每组5只。如表1。
其中干扰素分4个剂量治疗组:单独干扰素治疗组、低剂量组(20万单位/kg)、中剂量组(推荐剂量,40万单位/kg)、高剂量组(80万单位/kg),分别给予相应剂量生产批号为20080101的注射用重组犬干扰素α突变体(冻干型)。
第7组和第8组分别给予生产批号为20080301和20080401的注射用重组犬干扰素α突变体(冻干型),剂量为40万单位/kg。
根据临床出现症状,各犬均给予以下药物进行辅助治疗,纠正电解质紊乱和酸碱平衡措施,防止细菌性继发感染。
静脉滴注:复方氯化钠注射液(100ml),乳酸钠注射液(50ml),10%氯化钾注射液(1ml),庆大霉素注射液(3万单位),654-2注射液(0.8ml),VB6(1ml),VK3(1ml,仅出现血便时使用)。
肌肉注射:止血敏(1ml,仅出现血便时使用),安乃近注射液(0.8ml,仅出现高热时使用)。
口服给药:口服补液盐(13.95g)、安贝消食片(1片)、土霉素片(125mg)。
对辅助治疗组各犬仅采取每天1次的辅助治疗措施,单独干扰素治疗组仅给予每天一次的中剂量干扰素,其他干扰素治疗组犬,除给予相应剂量干扰素外,同时采取每天1次的对症辅助治疗措施。
各组发病犬除感染对照组外,均于出现呕吐、精神沉郁或腹泻症状时开始按表1给药治疗,给药疗程均为7天。干扰素给药途径为颈背部皮下注射。
2.6 观察项目
在接毒前、发病后治疗前及治疗后分别进行临床检查,观察项目包括精神状态、体温、饮食欲、呕吐、腹泻、粪便潜血等。
2.7 疗效判定标准
死亡率:凡在试验期间,出现犬细小病毒病的典型临床症状并死亡,病理解剖典型病理变化。取肠系膜淋巴结、小肠内容物,分离到犬细小病毒。其他原因致死者除外。根据因犬细小病毒感染死亡犬数计算各组的死亡率。
有效率:凡在试验期间,经给药后呕吐、下痢、便血停止,体温、心率、精神状况及食欲恢复正常,治疗结束后观察7天无异常者,判为有效,根据治愈犬占整组试验犬的比例计算有效率。
2.8 数据分析处理
用生物统计学方法进行数据的显著性检验。
3.试验结果及分析
3.1 犬细小病毒种毒毒力测定
代号为CPV-2-2的犬细小病毒毒株,按常规方法用猫肾细胞系(FK81)细胞测得其组织细胞半数感染剂量(TCID50)为10-7/100μl。
3.2 病毒滴度测定
以猪醛化红细胞测定犬细小病毒毒株CPV-2-2的血凝价(HA)为26。
3.3 种毒鉴定
以PCR法进行犬细小病毒毒株CPV-2-2的鉴定,结果表明,PCR产物经1.2%琼脂糖凝胶电泳,所设计的引物成功地扩增出了特异性的条带,大小约为1247bp和746bp,与预计的大小一致。
3.4 疾病模型复制
按每1kg体重肌肉注射0.2×10-7/100 μl TCID50的犬细小病毒剂量接种,大多数犬于接种后第6-8天开始出现临床症状,最初出现精神沉郁,喜卧,活动明显减少,排粪次数增加,粪便显黄色或灰黄色,稀如粥状,散发特殊的腥臭味,多数犬病初出现呕吐症状,呕吐物为白色粘液或泡沫,体温39.0-40.5℃。发病严重犬约1天后排粪呈喷射状,水样粪便,严重者粪便带血,呈淡红色或番茄酱样,混有黏液或伪膜。严重腹泻病犬迅速脱水,眼窝凹陷,皮肤弹性减退等。对发病死亡犬进行剖检,十二指肠及空肠黏膜严重出血,肠腔内有大量番茄样粪便,肠系膜淋巴结肿胀、出血。
取发病犬新鲜粪便用犬细小病毒快速诊断试纸进行实验室诊断,阳性率达95%(表2)。
取病死犬十二指肠或空肠内容物及肠系膜淋巴结,研磨制成10×乳悬液,冻融数次后离心,取上清接种FK81细胞,72h后,细胞出现圆缩、脱落,产生拉网现象,7只发病死亡犬均分离到犬细小病毒。提取病毒基因组DNA,并以此DNA为模板,采取人工合成的正反引物进行PCR扩增,PCR产物经琼脂糖凝胶电泳鉴定是否获得了预计长度的DNA片段(1247bp和746bp),可确定为犬细小病毒毒株,表明成功复制犬细小病毒病的疾病模型。
3.5 治疗结果
各组发病犬除感染对照组外,均于出现呕吐、精神沉郁或腹泻症状时开始按表1给药治疗7天。
感染对照组5只犬中两只死亡,其他3只均出现消瘦、体质衰弱。
辅助治疗组各犬每天1次给予对症治疗,5只犬中,有一只犬于给药治疗后第3天死亡,其余4只均连续给药7天,至给药结束后第7天仍有2只犬未完全康复,表现为精神沉郁、食欲减退、体重下降。
单独干扰素治疗组各犬仅每天一次皮下注射给予中剂量干扰素(40万单位/kg),有2只犬于给药治疗后第3天和第4天死亡,死亡原因主要为剧烈腹泻导致脱水和肠道出血。
干扰素低剂量组5只犬除每天一次皮下注射给予20万单位/kg干扰素外,同时结合辅助治疗措施。5只犬中仅有一只犬于给药后第2天死亡。其他4只犬均于连续给药3天后出现明显好转,呕吐、腹泻症状得到缓解,给药5-7天后均基本痊愈,至给药结束后第7天,精神、食欲恢复正常。
干扰素中剂量与高剂量组5只犬除每天一次皮下注射给予40或80万单位/kg干扰素外,同时结合辅助治疗措施。10只犬均于连续给药3-4天后出现明显好转,呕吐、腹泻症状得到缓解,给药5-7天后均基本痊愈,至给药结束后第7天,精神、食欲恢复正常。
第7组和第8组分别给予生产批号为20080301和20080401的注射用重组犬干扰素α突变体(冻干型),剂量为40万单位/kg,同时结合辅助治疗措施。10只犬均于连续给药3-4天后出现好转,呕吐、腹泻症状得到缓解,给药5-6天后均基本痊愈至给药结束后第7天,精神、食欲恢复正常。
4.结论
由北京铁草科技有限公司生产的注射用重组犬干扰素α突变体(冻干型)皮下注射给药7天,同时结合对症治疗措施,可有效控制人工感染的毕格犬细小病毒病,改善临床症状,缩短病程,有效率达100%,显著降低死亡率,其治疗效果显著优于单独应用干扰素(有效率25%,死亡率50%)或仅辅助治疗组(有效率40%,死亡率20%)及感染对照组(死亡率40%)。
北京铁草科技有限公司生产的注射用重组犬干扰素α突变体(冻干型)皮下注射给药,结合对症治疗时,给药剂量以40-80万单位/kg的治疗效果最佳。
为了考察产品批次间的稳定性,使用北京铁草科技有限公司生产的3批次注射用重组犬干扰素α突变体(冻干型),以40万单位/kg剂量皮下注射给药,均能有效控制人工感染的毕格犬细小病毒病,有效率100%,无死亡,疗效稳定,三批次产品间无显著差异。
与干扰素+辅助治疗各组相比,单独使用干扰素效果不理想,分析原因,是由于犬细小病毒病引起幼犬呕吐、腹泻而脱水、电解质紊乱、酸中毒、高热、出血等严重临床症状,不能得到及时控制而导致死亡,提示在临床应用该产品治疗犬细小病毒病时一定要配合辅助疗法,才能取得较佳的疗效,这已在4-8组的治疗中得到验证。
参考文献
[1] 兽用生物制品实验室效力试验技术指导原则.
[2] 庞志明,招松芳. 幼犬细小病毒病的病理模型研究.广东畜牧兽医科技,2003,28(5):42-45.
[3] 陈世铭,夏咸柱. 犬痢汤对实验性犬细小病毒肠炎的疗效观察. 1984,4(2):115-119.
[4] 杨举伦,倪汝选. 实验性犬细小病毒感染及其病理形态学研究. 1986,6(4):378-387.
[5] 罗绍忠,肖啸,徐学前. 复方泛菌克对犬细小病毒的临床疗效观察.中国兽药杂志,2007,3.